- 醫療器械注冊
- 第二類醫療器械注冊 第三類醫療器械注冊 進口醫療器械注冊 第一類醫療器械備案 體外診斷試劑注冊 醫療器械注冊體系考核 醫療器械生產許可證
- 醫療器械CE認證
- 醫療器械CE認證 FDA注冊(備案) 醫療器械境外注冊服務 ISO13485認證 ISO15378醫療包材體系認證 MDSAP認證服務 ISO13485內審員培訓
- 醫療器械臨床試驗
- 醫療器械臨床試驗服務 同品種比對臨床評價 體外診斷試劑(IVD)臨床試驗服務 臨床協調員(CRC)服務 進口醫療器械補充臨床試驗服務 醫院臨床試驗機構備案服務 醫療器械主文檔登記
- 醫療器械經營許可
- 醫療器械經營許可證辦理 第二類醫療器械經營備案 醫療器械網絡銷售備案 醫療器械分類界定代辦 醫療器械飛行檢查服務 醫療器械注冊檢驗資質 獸藥經營許可證辦理
- 聯系我們

聯系電話:0571-86198618手機: 18058734169 (微信同)手機:18868735317(微信同)周一至周日 8:00~22:00
在線客服周一至周日 8:00~22:00
-
心臟脈沖電場消融儀臨床試驗設計實例 心臟脈沖電場消融儀在我國屬于第三類醫療器械注冊產品,且不在免于醫療器械臨床試驗目錄內,因此,醫療器械注冊人需要通過醫療器械臨床試驗或是同品種對比臨床評價方式完成臨床評價,本文為大家介紹心臟脈沖電場消融儀臨床試驗設計實例,一起看正文。 時間:2024-12-21 19:03:45 瀏覽量:22

-
第三類醫療器械臨床試驗設計實例(人工血管) 近日,國家藥監局公開了人工血管這個第三類醫療器械的注冊審評報告,對于第三類醫療器械來說,注冊申請人對如何開展醫療器械臨床試驗非常關心,本文為大家說說人工血管臨床試驗設計實例,一起看正文。 時間:2024-12-14 21:10:36 瀏覽量:83

-
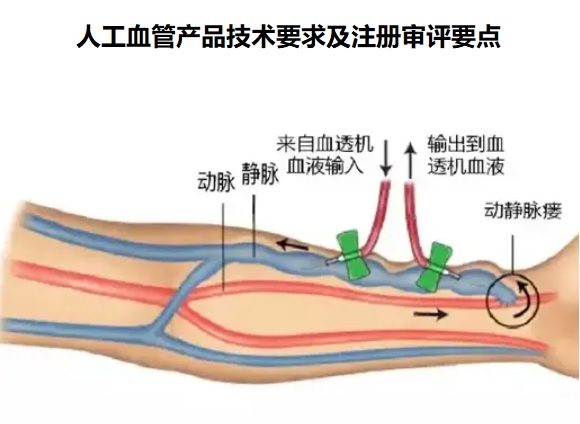
人工血管產品技術要求及注冊審評要點 適用于動靜脈瘺的建立的人工血管在我國屬于第三類醫療器械注冊產品,該產品為多層結構,在膨體聚四氟乙烯(ePTFE)內層 和聚對苯二甲酸乙二醇酯(PET)編結物外層之間,有加強型聚丙烯(PP)支撐環和硅膠層。環氧乙烷滅菌,一次性使用。本文為大家介紹人工血管產品技術要求及注冊審評要點,一起看正文。 時間:2024-12-13 23:06:48 瀏覽量:156
-
導光凝膠(光子冷凝膠)產品技術要求及醫療器械備案要點 用于光子治療過程中隔熱和導光,與光子治療設備配合使用的導光凝膠,在行業內又叫光子冷凝膠,根據最新醫療器械分類目錄,導光凝膠在我國屬于第一類醫療器械備案產品,本文為大家介紹導光凝膠(光子冷凝膠)產品技術要求及醫療器械備案要點,一起看正文。 時間:2024-12-9 20:10:52 瀏覽量:299
-
定制式活動義齒注冊審評要點 用于牙列缺損、牙列缺失的活動修復的定制式活動義齒在我國屬于第二類醫療器械注冊產品,依據醫療器械分類目錄,分類編碼為:17-06-04,考慮到定制式活動義齒的廣泛需求,本文從定制式活動義齒注冊審評視角,帶大家了解定制式活動義齒注冊審評要點,一起看正文。 時間:2024-12-9 19:50:43 瀏覽量:176

-
碳離子治療系統同品種臨床評價成功案例 ?提供碳離子束用于成人惡性實體腫瘤治療的碳離子治療系統,由加速器子系統和治療子系統組成,其中加速器 子系統包括注入器系統、主加速系統、加速器輔助系統,治療子系統包括 4 個治療室、物理計劃室和共用部分。碳離子治療系統在我國屬于第三類醫療器械注冊產品,且不在免于開展醫療器械臨床試驗目錄之內,今天為大家介紹碳離子治療系統同品種臨床評價成功案例,一起看正文。 時間:2024-12-4 23:07:20 瀏覽量:217

-
超聲診斷系統同品種臨床評價成功案例 超聲診斷系統在我國屬于第三類醫療器械注冊產品,其不在當前免于開展醫療器械臨床試驗目錄內,因此,醫療器械注冊人需要通過同品種臨床評價或是醫療器械臨床試驗完成臨床評價,考慮到同品種臨床評價相比醫療器械臨床試驗在費用和周期方面的優勢,本文為大家介紹超聲診斷系統同品種臨床評價成功案例,一起看正文。 時間:2024-12-2 20:04:07 瀏覽量:271

-
熒光成像功能醫療器械注冊產品同品種臨床評價要點 ?熒光成像功能不屬于已列入《免于臨床評價醫療器械目錄(2021年)》(簡稱《目錄》)產品的功能,醫療器械注冊人需要通過同品種臨床評價或是醫療器械臨床試驗完成產品的臨床評價,考慮到同品種臨床評價的可行性及相比醫療器械臨床試驗的巨大優勢,本文為大家介紹熒光成像功能醫療器械注冊產品同品種臨床評價要點。 時間:2024-11-29 20:47:44 瀏覽量:221

-
第一類醫療器械(含體外診斷試劑)生產備案相關法律法規有哪些? ?對于第一類醫療器械備案企業或是第一類醫療器械生產企業來說,合規開展生產和經營是基本要求,經常有朋友問到第一類醫療器械(含體外診斷試劑)生產備案相關法律法規有哪些?因此,寫個文章一并說明。 時間:2024-11-24 22:47:51 瀏覽量:668

-
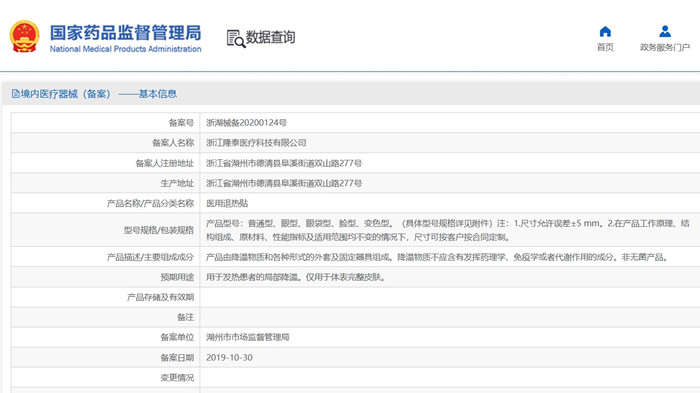
醫用退熱貼產品技術要求及第一類醫療器械備案資質申請要求 用于發熱患者的局部降溫(僅用于體表完整皮膚)的醫用退熱貼在我國屬于第一類器械備案產品。產品通常由降溫物質和各種形式的外套及固定器具組成。降溫物質不應含有發揮藥理學、免疫學或者代謝作用的成分。非無菌產品。本文為大家介紹醫用退熱貼產品技術要求及第一類醫療器械備案資質申請要求,一起看正文。 時間:2024-11-11 18:31:47 瀏覽量:845
-
上海市第二類創新醫療器械特別審查指南 ?2024年11月5日,為幫助和指導申請人做好本市第二類創新醫療器械審查資料的準備和撰寫,進一步規范相關審查工作,上海器審中心組織制定了《本市第二類創新醫療器械特別審查指南》,現予發布。本指南是對申請人和技術審評人員的指導性文件,不作為法規強制執行。隨著《上海市第二類創新醫療器械特別審查程序》的不斷完善,本指南相關內容也將適時進行調整。 時間:2024-11-8 20:36:32 瀏覽量:562

-
杭州市市場監督管理局對醫療器械經營許可證持有企業飛行檢查主要內容 時間:2024-11-8 19:28:52 瀏覽量:594

-
境內第三類醫療器械注冊質量管理體系核查工作程序 為做好醫療器械注冊質量管理體系核查工作,根據《醫療器械監督管理條例》(國務院令第739號)《醫療器械注冊與備案管理辦法》(國家市場監督管理總局令第47號)和《體外診斷試劑注冊與備案管理辦法》(國家市場監督管理總局令第48號)等相關規定,制定《境內第三類醫療器械注冊質量管理體系核查工作程序》。 本程序適用于境內第三類醫療器械注冊質量管理體系核查。 時間:2024-11-3 22:17:31 瀏覽量:733
-
注冊用途體外診斷試劑臨床試驗應選擇多少家臨床試驗機構? 對于不在免于開展體外診斷試劑臨床試驗目錄內的產品來說,體外診斷試劑擬上市注冊臨床試驗應選擇多少家臨床試驗機構開展臨床試驗? 時間:2024-10-30 20:41:34 瀏覽量:373

-
醫用放大鏡產品技術要求及醫療器械備案資質申請要求 醫用放大鏡是生物醫學行業發展的里程碑設備之一,為生命健康行業帶來了微觀視角看待生命和微生物世界。醫用放大鏡在我國歸屬于第一類醫療器械備案產品,本文為大家說說醫用放大鏡產品技術要求及醫療器械備案資質申請要求。 時間:2024-10-27 22:25:05 瀏覽量:1081

-
口腔數字觀察儀產品技術要求及醫療器械備案資質申請要求 ?用于對口腔局部觀察的口腔數字觀察儀在我國屬于第一類醫療器械備案產品,口腔數字觀察儀通常由攝像手柄和顯示器組成。利用攝像功能,觀察口腔內各部位狀態的設備。作為口腔常用器械,本文為大家介紹口腔數字觀察儀產品技術要求及醫療器械備案資質申請要求,一起看正文。 時間:2024-10-20 18:40:05 瀏覽量:1009

-
備皮刀醫療器械備案資質申請流程和要求 用于手術前備皮的備皮刀,通常由刀片、刀架和保護蓋片組成,夾持刀片下夾板的前緣有梳齒,備皮刀在我國屬于第一類醫療器械備案產品,可重復使用。在醫療護理領域,備皮刀作為手術前準備的重要工具,其安全性和合規性直接關系到患者的健康與安全。在這樣的背景下,了解并滿足備皮刀作為醫療器械的資質要求與申請流程,成為了醫療用品生產企業不可或缺的一環。本文為您帶介紹備皮刀醫療器械備案資質申請流程和要求,一起看正文。 時間:2024-10-16 19:56:10 瀏覽量:1200

-
常規已取得醫療器械注冊證企業委托生產辦理流程 對于醫療器械注冊企業來說,按照傳統注冊路徑,醫療器械注冊人也是醫療器械生產企業。醫療器械注冊人為醫療器械注冊提供了新的路徑,可以采用委托生產模式將醫療器械注冊人和醫療器械生產企業聯合申請醫療器械注冊。此外,傳統醫療器械注冊企業亦可以按照醫療器械注冊制度委托生產,本文為大家說說常規醫療器械注冊企業委托生產辦理流程,一起看正文。 時間:2024-9-7 18:51:16 瀏覽量:1112

-
第二類醫療器械臨床試驗核查評價依據是什么? 醫療器械臨床試驗核查日趨頻繁,對于開展醫療器械臨床試驗的第二類醫療器械注冊人來說,熟悉并滿足第二類醫療器械臨床試驗核查評價依據是基本課題。本文為醫療器械注冊申請人說說,申請注冊產品需進行第二類醫療器械臨床試驗核查的,其核查評價依據是什么?一起看正文。 時間:2024-8-31 20:49:12 瀏覽量:1055

-
浙江省醫療器械臨床試驗備案流程和要求 《醫療器械監督管理條例》第二十六條規定:開展醫療器械臨床試驗,應當按照醫療器械臨床試驗質量管理規范的要求,在具備相應條件的臨床試驗機構進行,并向臨床試驗申辦者所在地省、自治區、直轄市人民政府藥品監督管理部門備案。接受臨床試驗備案的藥品監督管理部門應當將備案情況通報臨床試驗機構所在地同級藥品監督管理部門和衛生主管部門。本文為大家介紹浙江省醫療器械臨床試驗備案流程和要求。 時間:2024-7-29 21:59:31 瀏覽量:1188

