適用于動靜脈瘺的建立的人工血管在我國屬于第三類醫療器械注冊產品�����,該產品為多層結構���,在膨體聚四氟乙烯(ePTFE)內層 和聚對苯二甲酸乙二醇酯(PET)編結物外層之間����,有加強型聚丙烯(PP)支撐環和硅膠層���。環氧乙烷滅菌,一次性使用。本文為大家介紹人工血管產品技術要求及注冊審評要點�����,一起看正文����。
適用于動靜脈瘺的建立的人工血管在我國屬于第三類醫療器械注冊產品�����,該產品為多層結構���,在膨體聚四氟乙烯(ePTFE)內層
和聚對苯二甲酸乙二醇酯(PET)編結物外層之間����,有加強型聚丙烯(PP)支撐環和硅膠層����。環氧乙烷滅菌,一次性使用�����。本文為大家介紹人工血管產品技術要求及注冊審評要點���,一起看正文����。
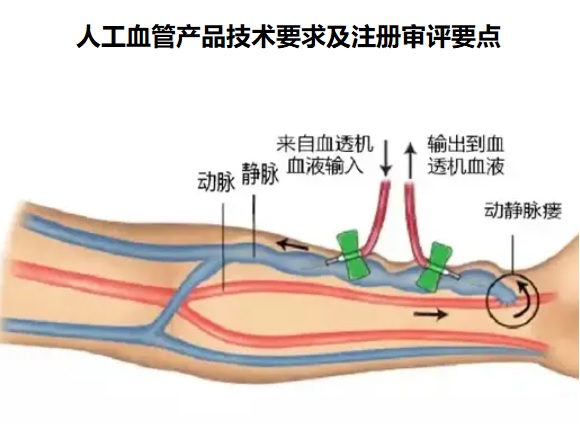
一、人工血管的工作原理
人工血管是一種非來源于自然器官和組織的血管代用
品���,人工血管可用于血液透析患者的動靜脈通路建立,在血
液通路手術中作為皮下動靜脈通路�����。
二����、人工血管產品技術要求
人工血管產品技術要求中的性能指標通常用包括:外觀����、自然狀態下內徑、有效長度、壁厚�����、水滲透壓���、軸向拉伸強度�����、圓周拉伸強度����、探針破裂強度����、牽拉強度、反復穿刺后圓周拉伸強度���、扭結半徑、擴張內徑����、動態順應性、微粒污染、單位面積重量�����、還原物質、蒸發殘渣、紫外吸光度����、酸堿度����、重金屬總量�����、環氧乙烷殘留量���、六甲基二硅氧烷殘留量���、無菌�����、細菌內毒素這24項性能指標。
三、人工血管產品注冊時���,生物相容性試驗應開展哪幾項?
人工血管為植入器械,與人體循環血液長期接觸���。醫療器械注冊申請人依據 GB/T 16886 系列標準進行了生物相容性評價,選擇了材料表征、毒理學評價和生物學試驗的方式進行風險評定�����,開展的生物學試驗包括溶血���、血栓形成�����、凝血、熱原�����、急性全身毒性����、細胞毒性、致敏����、皮內反應���、植入后局部組織反應���、遺傳毒性�����、亞慢性全身毒性;針對亞急性毒性����、慢性毒性�����、致癌性終點開展了評價�����。
如有人工血管產品注冊咨詢服務需求�����,或是其他第三類醫療器械注冊代理服務需求�����,歡迎您隨時方便與杭州證標客醫藥技術咨詢有限公司聯絡,聯系人:葉工���,電話:18058734169,微信同����。