- 聯系我們

聯系電話:0571-86198618手機: 18058734169 (微信同)手機:18868735317(微信同)周一至周日 8:00~22:00
在線客服周一至周日 8:00~22:00
-
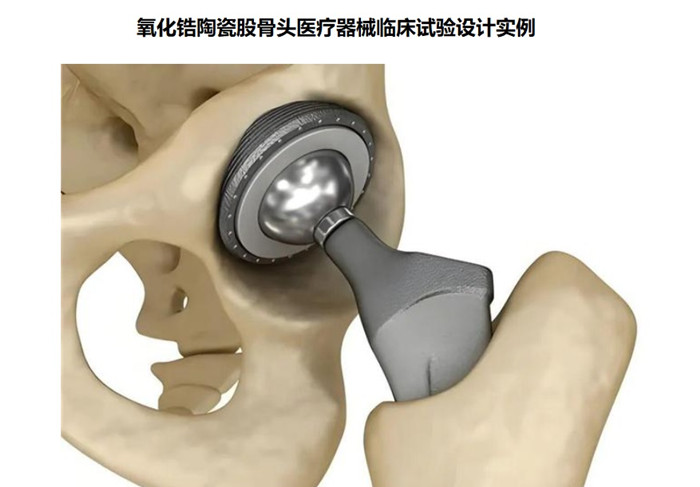
氧化鋯陶瓷股骨頭醫療器械臨床試驗設計實例 氧化鋯陶瓷股骨頭為髖關節假體組件,股骨柄部插入股骨髓腔內后, 陶瓷股骨頭與髖臼內襯、髖臼(外)杯形成旋轉關節面, 實現髖關節的運動。利用機械原理形成新的關節活動。氧化鋯陶瓷股骨頭在我國屬于第三類醫療器械注冊產品,目前,需要通過醫療器械臨床試驗完成臨床評價,本文為大家介紹氧化鋯陶瓷股骨頭醫療器械臨床試驗設計實例,一起看正文。 時間:2024-11-26 0:00:00 瀏覽量:201
-
醫療器械注冊產品包裝不同,是否可以劃為同一注冊單元 對于醫療器械注冊產品來說,考慮到不同市場和客戶的不同需求,同樣產品的包裝可能有紙塑包裝、吸塑包裝、瓶裝等等不同包裝形式。從醫療器械注冊人角度,當然是希望不同包裝能夠放到同一醫療器械注冊單元中。這樣是否允許呢?一起看正文。 時間:2024-11-25 0:00:00 瀏覽量:225

-
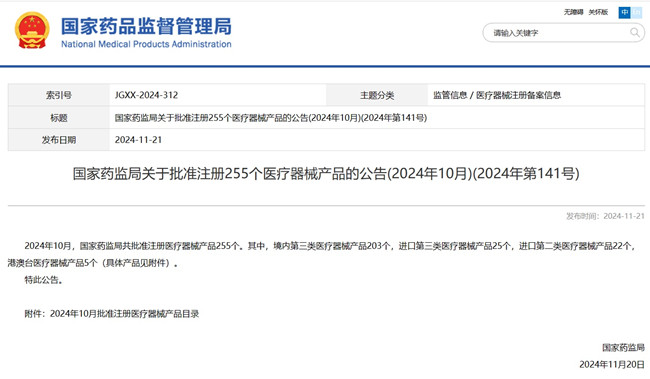
國家藥監局2024年10月批準進口醫療器械注冊產品47項 來自國家藥監局披露的數據,2024年10月,國家藥監局共批準進口醫療器械注冊產品47個。其中進口第三類醫療器械注冊產品25個,進口第二類醫療器械注冊產品22個。此外,批準港澳臺醫療器械注冊產品5個,一起來看具體是哪些產品獲批。 時間:2024-11-25 0:00:00 瀏覽量:250
-
什么是第一類醫療器械(含體外診斷試劑)生產備案? ?大家經常說到第一類醫療器械備案,不時的會有朋友問答我什么是第一類醫療器械備案,對于第一類醫療器械備案事項來說,具體包括三個部分:一是第一類器械產品備案,二是第一類醫療器械生產備案;三是建立醫療器械生產質量管理體系,本文為大家說說什么是第一類醫療器械(含體外診斷試劑)生產備案,一起看正文。 時間:2024-11-24 22:39:35 瀏覽量:249

-
一次性使用無菌尿道擴張器產品技術要求及醫療器械注冊審查要點 用于擴張尿道的一次性使用無菌尿道擴張器在我國屬于無菌第二類醫療器械注冊產品,產品通常由擴張管、導絲組成,導絲由內芯和包塑管制成。近日,國家藥監局發布《一次性使用無菌尿道擴張器注冊審查指導原則(征求意見稿)》,正好借這個機會,為大家介紹一次性使用無菌尿道擴張器產品技術要求及醫療器械注冊審查要點,一起看正文。 時間:2024-11-23 0:00:00 瀏覽量:227

-
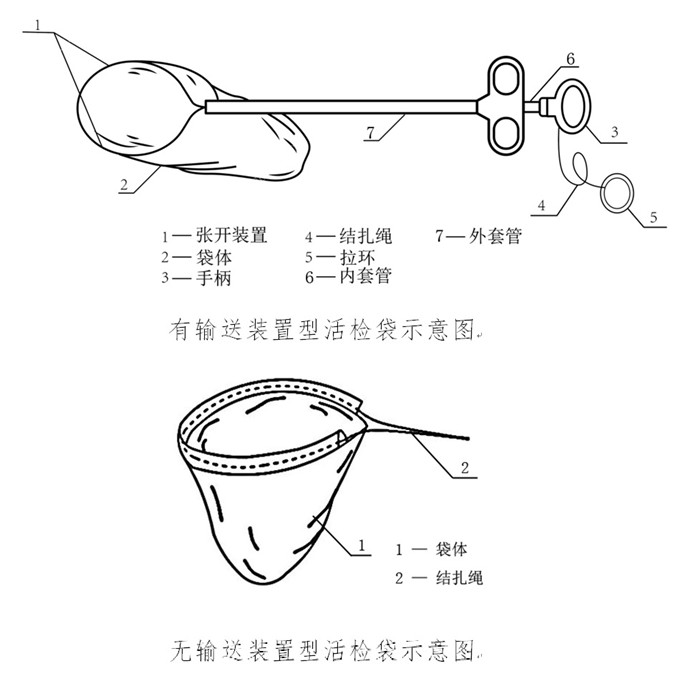
一次性使用內窺鏡用活檢袋注冊及醫療器械生產許可證辦理要點 用于腔鏡手術時將活檢樣本從手術區域取出的一次性使用內窺鏡用活檢袋,在我國屬于第二類醫療器械注冊產品。活檢袋通常分為有輸送裝置型和無輸送裝置型兩種,產品通常由活檢袋套管、納物袋、結扎繩、撐開鉗構成。近日,國家藥監局發布《一次性使用內窺鏡用活檢袋注冊審查指導原則(征求意見稿)》,正好借這個機會,為大家介紹一次性使用內窺鏡用活檢袋注冊及醫療器械生產許可證辦理要點,一起看正文。 時間:2024-11-23 21:33:36 瀏覽量:205
-
創新醫療器械注冊產品(氧化鋯陶瓷股骨頭)獲批上市 近日,國家藥品監督管理局批準了北京安頌科技有限公司“氧化鋯陶瓷股骨頭”創新產品注冊申請。該產品為髖關節假體組件,由氧化鋯陶瓷材料制成,與同企業同系列組件配合,適用于髖關節置換。該產品采用高低溫循環燒結技術,降低了燒結的高溫溫度,既為晶界擴散提供驅動力,又可避免高溫溫度過高引起的性能不佳問題。 時間:2024-11-22 16:31:42 瀏覽量:219

-
牙科種植體系統綜述資料與已上市同類產品的對比需考慮哪些內容? 適用于牙缺失患者的種植修復,是用外科方法將種植體植入到牙槽骨內,用于為義齒等修復體提供固定或支撐,以恢復患者的咀嚼功能的牙科種植體系統,在我國屬于植入類第三類醫療器械注冊產品。由于人均壽命的大幅增加及食物的多樣性,口腔疾病日益增多,牙科種植體系統成為熱門醫療器械產品之一。本文從醫療器械注冊視角,為大家說說牙科種植體系統綜述資料與已上市同類產品的對比需考慮哪些內容?一起看正文。 時間:2024-11-22 0:00:00 瀏覽量:194
-
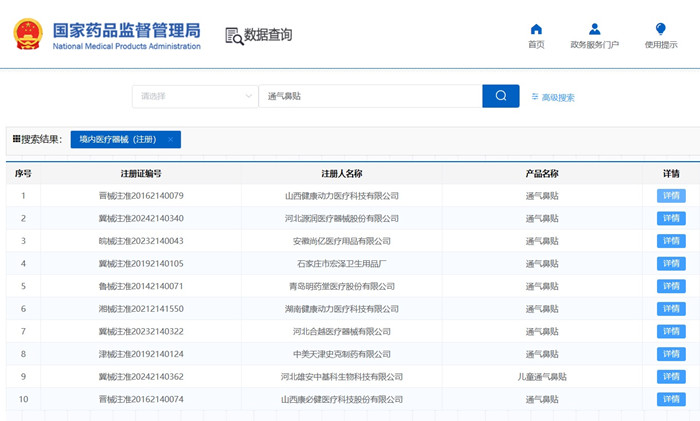
通氣鼻貼產品技術要求及醫療器械注冊審查要點 ?用于擴張鼻孔,緩解鼻塞用的通氣鼻貼在我國屬于第二類醫療器械注冊產品。近日,國家藥監局發布《通氣鼻貼注冊審查指導原則(征求意見稿)》,本文為大家介紹通氣鼻貼產品技術要求及醫療器械注冊審查要點,一起看正文。 時間:2024-11-20 22:14:22 瀏覽量:281
-
一次性使用鼻鏡產品技術要求及醫療器械注冊審查要點 用于鼻腔的檢查的一次性使用鼻鏡在臨床上廣泛應用,盡管用于自然腔道檢測,一次性使用鼻鏡多數仍然是無菌狀態提供,降低了患者檢查過程中的感染風險,也減少了重復使用器械的滅菌消毒工作。本文為大家介紹一次性使用鼻鏡產品技術要求及醫療器械注冊審查要點,一起看正文。 時間:2024-11-20 20:26:00 瀏覽量:181

-
第二類醫療器械臨床試驗選擇一家研究中心(醫院等)是否合規? 對于醫療器械臨床試驗的研究中心數量要求,大家可能還停留在二類醫療器械需要在2家及以上研究中心開展,三類醫療器械需要在3家及以上研究中心開展。時至今日,有關醫療器械臨床試驗機構要求的規定發生了變化,研究中心的數量限制更多交給了專業的醫療器械臨床試驗設計人員及醫療器械臨床試驗研究者們。 時間:2024-11-19 20:00:04 瀏覽量:187

-
第二類、第三類醫療器械注冊人可以跨省委托生產嗎? 盡管醫療器械注冊人全國范圍施行已經有很長一段時間,但由于許多醫療器械行業之外的朋友跨行進入這個行業。正好今天有客戶問到我第二類、第三類醫療器械注冊人是否可以跨省委托生產這個話題,證標客作為很早全國范圍開展醫療器械注冊人制度相關咨詢服務機構之一,有必要再跟科普這個事,一起看正文。 時間:2024-11-19 19:46:54 瀏覽量:233
-
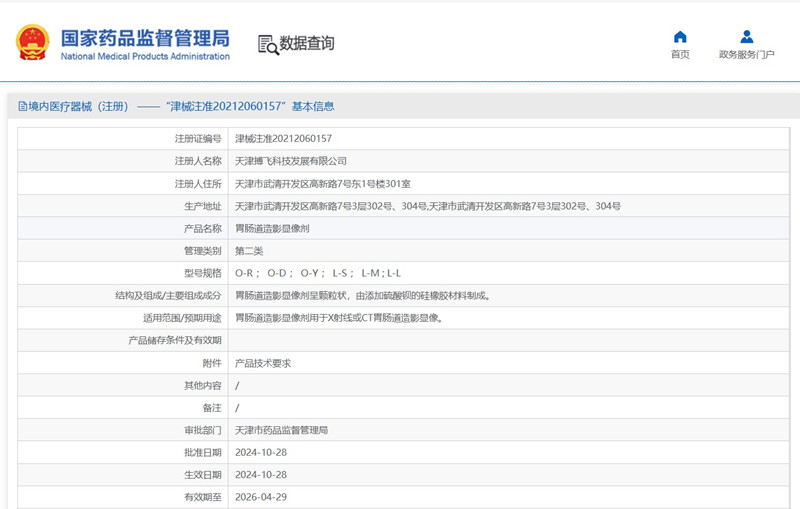
胃腸道造影顯像劑產品技術要求及注冊審查要點 ?用于CT胃腸道造影顯像的胃腸道造影顯像劑產品,在我國屬于第二類醫療器械注冊產品,分類編碼為06醫用成像器械-05X射線附屬及輔助設備-14 胃腸X射線檢查用品。成分通常為食用級液體石蠟、添加劑、純化水等。用于CT胃腸道造影顯像。所含成分不具有藥理學作用。本文為大家說說胃腸道造影顯像劑產品技術要求及注冊審查要點,一起看正文。 時間:2024-11-18 0:00:00 瀏覽量:229
-
內窺鏡手術用剪產品技術要求及注冊審查要點 ?在內窺鏡檢查和手術中配合內窺鏡使用的無源內窺鏡用剪,在我國屬于第二類醫療器械注冊產品,依據最新適用的《醫療器械分類目錄》,其分類編碼為02-03-03。近日,國家藥監局發布了《內窺鏡手術用剪注冊審查指導原則(征求意見稿)》,正好帶大家了解內窺鏡手術用剪產品技術要求及注冊審查要點。 時間:2024-11-18 21:19:10 瀏覽量:196

-
胃鏡潤滑液產品技術要求及注冊審查要點 胃鏡潤滑液通常由甘油、黃原膠等組成,所含成分不具有藥理學作用,產品主要用于減少胃鏡和咽喉、食管及胃黏膜之間的摩擦,減輕插入和操作過程的不適感,提高患者的舒適度,提高醫生的操作效率。近日,國家藥監局發布《胃鏡潤滑液產品注冊審查指導原則(征求意見稿)》,正好,今天給大家說說胃鏡潤滑液產品技術要求及注冊審查要點,一起看正文。 時間:2024-11-17 20:16:18 瀏覽量:265

-
弱視治療設備產品技術要求及注冊審查要點 電子產品在生活中的廣泛應用,為大眾帶來方便的同時,也讓弱視近視患者越來越多。因此,也出現來越來越多致力于弱視治療的醫療器械產品,本文為大家說說弱視治療設備(第二類醫療器械注冊產品)產品技術要求及注冊審查要點,一起看正文。 時間:2024-11-17 20:03:00 瀏覽量:256

-
美敦力公司MEDTRONIC INC.對進口醫療器械注冊產品(順行灌注插管)主動召回 來自國家藥監局2024年11月15日披露的消息,由于包裝密封問題,生產商美敦力公司MEDTRONIC INC.對其生產進口醫療器械注冊產品,順行灌注插管Cardioplegia Delivery Cannula(國械注進20153101305)主動召回。 時間:2024-11-16 21:06:00 瀏覽量:314

-
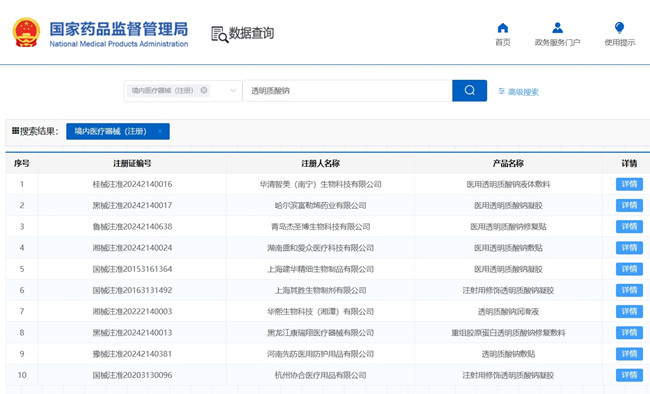
銷售透明質酸鈉類產品是辦理醫療器械經營許可證還是醫療器械備案證? 考慮到一是透明質酸鈉類產品在醫美行業的廣泛應用,特別是美容線下渠道和電商、微商線上渠道;二是透明質酸鈉類產品是近年嚴監管的產品,且產品管理類別相對復雜。因此,寫個文章,為大家說說銷售透明質酸鈉類產品是辦理醫療器械經營許可證還是醫療器械備案證,一起看正文。 時間:2024-11-16 20:57:40 瀏覽量:327
-
透明質酸鈉類產品技術要求需制定哪些性能指標? 考慮到透明質酸鈉類注冊產品具有共性,透明質酸鈉類產品技術要求也具有共性性能指標要求,而確定性能指標對于醫療器械注冊人及注冊項目及其重要,本文為大家介紹如何制定透明質酸鈉類產品技術要求中的性能指標,一起看正文。 時間:2024-11-15 0:00:00 瀏覽量:215

-
如何驗證透明質酸鈉類產品與滅菌過程的適應性? 透明質酸鈉類產品是醫美行業的明星產品之一,多數透明質酸鈉注冊產品都是以無菌形式提供,對于醫療器械注冊人來說,了解滅菌過程是基本要求。本文為大家說說如何驗證透明質酸鈉類產品與滅菌過程的適應性,一起看正文。 時間:2024-11-15 22:03:53 瀏覽量:227

