用于鼻腔的檢查的一次性使用鼻鏡在臨床上廣泛應用�,盡管用于自然腔道檢測�����,一次性使用鼻鏡多數仍然是無菌狀態提供�,降低了患者檢查過程中的感染風險�,也減少了重復使用器械的滅菌消毒工作。本文為大家介紹一次性使用鼻鏡產品技術要求及醫療器械注冊審查要點�,一起看正文�����。
用于鼻腔的檢查的一次性使用鼻鏡在臨床上廣泛應用,盡管用于自然腔道檢測�����,一次性使用鼻鏡多數仍然是無菌狀態提供��,降低了患者檢查過程中的感染風險,也減少了重復使用器械的滅菌消毒工作��。本文為大家介紹一次性使用鼻鏡產品技術要求及醫療器械注冊審查要點�����,一起看正文�。
一��、一次性使用鼻鏡產品設計開發
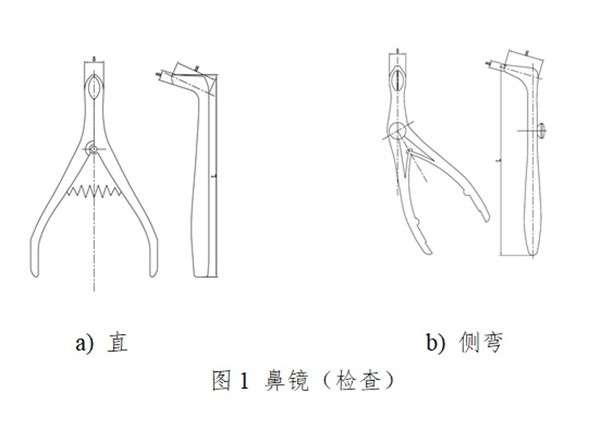
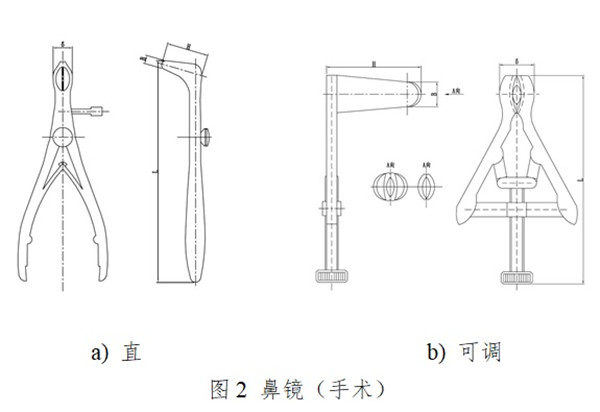
一次性使用鼻鏡包括檢查鼻鏡和手術鼻鏡�����。檢查鼻鏡供鼻腔檢查用,手術鼻鏡供鼻腔及鼻甲作檢查及手術用�����。通常由左片�����、右片��、銷(螺釘)、彈簧組成�����,無菌提供�。產品按第二類醫療器械管理,分類編碼為07-01-03�����。
一次性使用鼻鏡設計開發應以臨床為導向��,應能保證一次性使用鼻鏡擴展并暴露視野�����,滿足醫生進行觀察檢查及(或)手術用時的安全和有效。產品設計開發和生產過程應保證產生的析出物(包括可瀝濾物和/或蒸發物)�、降解產物�����、加工殘留物等降低到可接受水平,為患者提供最大程度的安全保障��。產品設計開發應考慮醫療器械可用性工程的要求�����。產品的使用應符合臨床操作規范及衛生行政主管部門的規定�。
二�、一次性使用鼻鏡注冊單元劃分
一次性使用鼻鏡注冊單元劃分原則上以產品的技術原理、主要結構組成�、性能指標和適用范圍為劃分依據�����,滿足《醫療器械注冊單元劃分指導原則》相關要求。
產品的適用范圍不同時,原則上劃分為不同的注冊單元�����。如檢查鼻鏡��、手術鼻鏡應劃分為不同注冊單元�。產品的關鍵組件結構差異導致適用范圍和/或性能要求不同時��,原則上劃分為不同的醫療器械注冊單元��。
三�����、一次性使用鼻鏡產品技術要求
一次性使用鼻鏡產品技術要求建議參考 YY/T 0189《鼻鏡》等相關標準�,結合產品設計特征及臨床應用來制訂��,同時還需符合《醫療器械產品技術要求編寫指導原則》的要求�。
產品技術要求中應明確型號規格及其劃分說明�、產品性能指標及檢驗方法、產品描述一般信息(原材料、結構組成、結構示意圖等)��。
產品性能指標應不低于產品適用的強制性國家標準/行業標準�����,若申報產品不適用強制性標準�����,提供說明以及經驗證的證明性資料。如產品有特定設計�����,申請人還應根據產品設計特征設定相應的性能指標�����,并將其列入產品技術要求��。
(1)產品型號/規格及其劃分說明
明確產品型號/規格,闡明各型號/規格間的區別及劃分說明,型號/規格的表述應與全部注冊申報資料保持一致�,并提供結構示意圖�。
(2)性能指標
鼻鏡產品性能指標至少應包含外觀��、尺寸、使用性能�、硬度(如適用)�、表面粗糙度(如適用)��、耐腐蝕性(如適用)��、反復開合無斷裂、無菌�����、化學性能(如適用)、環氧乙烷殘留量(如適用)等�。
(3)檢驗方法
產品的檢驗方法需優先采用國家標準/行業標準中的方法�。對于相關國家標準/行業標準中不適用的條款�����,需說明不適用的原因�����。所有引用的標準注明其編號、年號或版本號�����。必要時可以附錄形式采用相應圖示進行說明�����,文本較大的可以附錄形式提供�����。
如有一次性使用鼻鏡產品技術要求編寫或是醫療器械注冊咨詢服務需求,歡迎您隨時方便與杭州證標客醫藥技術咨詢有限公司聯絡��,聯系人:葉工��,電話:18058734169,微信同�。