- 聯系我們

聯系電話:0571-86198618手機: 18058734169 (微信同)手機:18868735317(微信同)周一至周日 8:00~22:00
在線客服周一至周日 8:00~22:00
-
美國FDA宣布計劃對大多數高風險IVD啟動再分類流程 相比常規醫療器械注冊產品,體外診斷試劑及體外診斷產品在全球主要醫療監管體系中的分類相對粗獷,歐盟在IVDR法規中對IVD產品的分類進行了重新劃定,我國也通過新發布體外診斷試劑目錄方式對之前分類進行了優化,2024年初,FDAFDA設備與放射衛生中心(CDRH)宣布計劃對大多數高風險IVD啟動再分類流程,主要是將按III類管理的部分高風險產品降為II類按中風險進行監管。 時間:2024-11-10 0:00:00 瀏覽量:267
-
FDA發布人工智能與醫療產品協同工作報告 2024年3月15日,美國FDA發布《人工智能與醫療產品:CBER、CDER、CDRH和OCP如何協同工作》報告,描述生物制品中心(CBER)、藥品中心(CDER)、器械中心(CDRH)和組合產品辦公室(OCP)在醫療產品生命周期中開發和使用人工智能技術的四個重點領域。 時間:2024-11-2 18:07:18 瀏覽量:236

-
無菌類器械 (510(k))申報資料中無菌證明資料遞交及審查指南發布 510(k)技術文檔資料是醫療器械FDA注冊的核心和難點,2024年1月8日,美國FDA發布《無菌類器械上市前通知(510(k))申報資料中關于無菌證明資料的遞交及審查》指南文件。該指南文件闡明在無菌類器械510(k) 申報資料中應包括的滅菌過程、熱原信息,一起看正文。 時間:2024-7-27 21:59:04 瀏覽量:543

-
醫療器械CE認證企業地址變更,需要更新哪些信息? 醫療器械生產企業地址變更時常有情況,對于申請了醫療器械CE認證的企業來說,如果工廠地址發生變化,需要對應更新哪些信息?一起看正文。 時間:2024-6-26 21:54:37 瀏覽量:542

-
醫療器械CE認證(MDR法規)對量效研究有什么要求? 我們知道,能量給與或是能量釋放類醫療器械的量效控制影響醫療器械的安全、有效性,是醫療器械注冊過程中要關注和考慮的要素,對于醫療器械CE認證(MDR法規)對量效研究有具體規定嗎?一起看正文。 時間:2024-6-19 22:32:17 瀏覽量:576

-
醫療器械CE認證(MDR法規)哪種臨床評價路徑可以免臨床試驗? 無論對于國內醫療器械注冊,還是醫療器械CE認證(MDR法規),是否可以豁免臨床試驗都是項目決策的重要考慮因素之一,本文為大家說說MDR法規哪種臨床評價路徑可以免臨床試驗,一起看正文。 時間:2024-6-18 15:41:31 瀏覽量:622

-
FDA發布《標注為無菌的器械的上市前通告(510(k))中無菌信息的提交和審查》指南 本指南文件更新并澄清了有關滅菌工藝的信息,FDA建議贊助商將其納入標注為無菌的器械的510(k)中。本指南文件還提供了FDA建議贊助商在510(k)提交文件中包含的致熱原信息的詳細內容。 時間:2024-3-19 0:00:00 瀏覽量:770

-
醫療器械CE認證法規之醫療器械相關文件的語言要求 對于醫療器械CE認證企業來說,務必要了解歐盟是由27個成員國組成,只有少數國家比如愛爾蘭的母語為英語。其他國家都有自己的其他官方語言。最近,歐盟發布了指南文件,總結了成員國的語言要求,供制造商和進口商參考。 時間:2024-1-25 0:00:00 瀏覽量:853

-
FDA對于組織工程醫療產品的監管情況介紹 國務院印發的《“健康中國2030”規劃綱要》中明確提出,發展組學技術細胞與再生醫學、新型疫苗、生物治療等醫學前沿技術;科技部重點專項中,“生物材料研發與組織器官修復替代”、“干細胞及轉化研究”位列其中;許多政策及科技項目均提出要加強再生醫學與組織工程研究工作。本文擬通過分析FDA對于該類產品的監管現狀,對我國監管政策制定提供參考。 時間:2023-12-24 0:00:00 瀏覽量:829

-
清洗消毒機在歐盟屬于幾類醫療器械? 對于醫療器械注冊產品分類來說,我國和美國FDA都有明確的分類清單表或分類數據庫,而歐盟采用的是判定樹和判定規則,本文為大家科普一下基于醫療器械CE認證新法規(MDR),清洗消毒機在歐盟屬于幾類醫療器械。 時間:2023-11-14 16:13:33 瀏覽量:900

-
醫療器械CE認證之生物相容性測試判定 無論對于國內醫療器械注冊,還是醫療器械CE認證、FDA注冊,判定醫療器械生物學風險是重要工作之一,而其中的關鍵是判定醫療器械產品與人體的接觸風險,或潛在接觸風險。 時間:2023-7-26 17:27:38 瀏覽量:1906
-
FDA510(K)申請流程 美國食品藥品監督管理局按風險高低將醫療器械分成ClassⅠ、ClassⅡ和ClassⅢ三個等級,ClassⅠ風險等級最低,ClassⅡ產品屬于中等風險產品,需要取得FDA 510(K)號后,方可取得進行FDA企業注冊登記。本文為大家介紹FDA510(K)申請流程。 時間:2023-7-4 15:31:56 瀏覽量:1103

-
醫療器械CE認證之歐盟對有源醫療器械的分類規則 新歐盟醫療器械CE認證法規MDR實施之后,有源醫療器械CE認證產品在歐盟屬于幾類醫療器械,如何判斷醫療器械在歐盟的分類?有哪些分類規則?一起來學習。 時間:2023-2-20 10:12:32 瀏覽量:1461

-
FDA發布《外科縫線–基于安全和性能的途徑的性能標準》指南文件 2022 年 4 月 11 日,美國FDA發布《外科縫線 – 基于安全和性能的途徑的性能標準》指南文件。旨在提供支持《基于安全和性能的途徑》的外科縫線性能標準。計劃使用該途徑提交外科縫線510(k) 申請的申請人,可以使用該指南中性能標準來支持實質等效性,而不是直接比較目標器械與等價器械的性能。 時間:2022-8-7 12:02:23 瀏覽量:1721

-
一文讀懂CE[IVDR法規]體外診斷設備分類規則 對于醫療器械CE認證來說,歐盟醫療器械法規升級后,醫療器械在歐盟的分類規則變化不大,而體外診斷試劑和體外診斷設備在歐盟的分類規則發生了巨大的變化,IVDR法規下,將體外診斷試劑和體外診斷設備分為A、B、C、D四個管理類別。一起來了解CE[IVDR法規]體外診斷設備分類規則。 時間:2022-7-13 0:00:00 瀏覽量:2222

-
醫療器械CE認證之MDR標簽標識要求 醫療器械標簽標識盡管簡單,但因為及其重要,也最直觀,也是最容易被監管到的錯誤事項,因此,了解并正常使用符合MDR法規的標簽標識,對醫療器械CE認證?企業來說非常重要。 時間:2022-6-28 15:34:56 瀏覽量:3397

-
關于《醫療器械分類目錄》目錄11、12、13、14、15、17、22相關產品臨床評價推薦路徑的通告 剛剛,為進一步指導注冊申請人確定具體產品的臨床評價路徑,器審中心發布關于發布《醫療器械分類目錄》子目錄11、12、13、14、15、17、22相關產品臨床評價推薦路徑的通告(2022年第20號)。 時間:2022-5-19 0:00:00 瀏覽量:2513

-
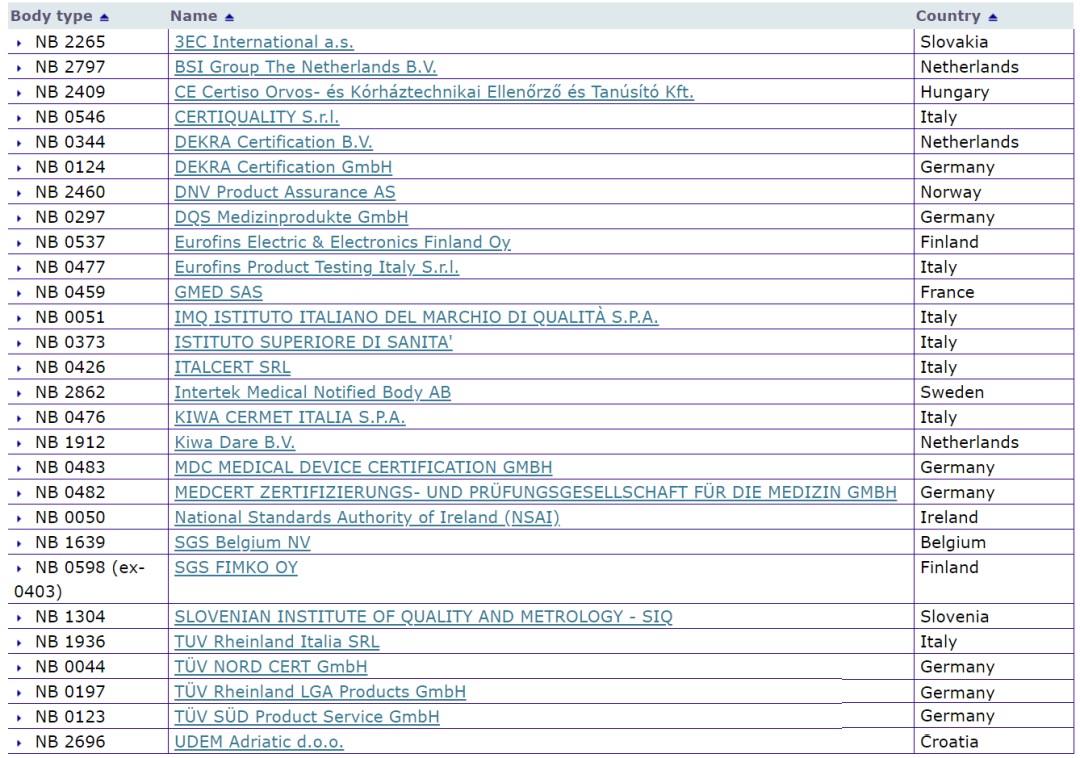
截止2022年5月1日,醫療器械CE認證MDR公告機構28家,IVDR7家 對于醫療器械CE認證市場來說,MDR及IVDR公告機構稀缺是近2年的痛點,截止2022年5月1日,醫療器械CE認證MDR公告機構增至28家,IVDR7家。 時間:2022-5-2 14:14:16 瀏覽量:2429
-
美國醫療器械軟件功能申報指南草案 軟件是否屬于醫用軟件?醫用軟件是否屬于醫療器械?這兩個問題都需要專業視角,具體判定。在業界,目前還存在相對模糊的地帶,對于軟件類醫療器械來說,完成醫療器械軟件注冊?申報是法規要求。本文為大家介紹美國醫療器械軟件功能申報指南草案。 時間:2022-4-26 14:57:12 瀏覽量:1895

-
醫療器械CE認證之臨床評價要點 MDR法規的生效,對整個醫療器械CE認證?行業來說,都將會有一個長期的學習和認知轉換過程。本文根據MDR附錄XIV的要求,整理出器械臨床評估要點。 時間:2022-4-17 16:39:59 瀏覽量:2461

