國務院印發的《“健康中國2030”規劃綱要》中明確提出,發展組學技術細胞與再生醫學、新型疫苗、生物治療等醫學前沿技術;科技部重點專項中,“生物材料研發與組織器官修復替代”、“干細胞及轉化研究”位列其中;許多政策及科技項目均提出要加強再生醫學與組織工程研究工作。本文擬通過分析FDA對于該類產品的監管現狀,對我國監管政策制定提供參考。
國務院印發的《“健康中國2030”規劃綱要》中明確提出,發展組學技術細胞與再生醫學、新型疫苗、生物治療等醫學前沿技術;科技部重點專項中,“生物材料研發與組織器官修復替代”、“干細胞及轉化研究”位列其中;許多政策及科技項目均提出要加強再生醫學與組織工程研究工作。2018年,再生醫學與組織工程等新興醫療產品正式列入國家藥品監督管理局的職能范圍。隨著技術發展,相關產品研發和申報數量日益增多,但對于該類產品的監管政策仍有待完善。本文擬通過分析FDA對于該類產品的監管現狀,對我國監管政策制定提供參考。
一、概況
美國食品藥品管理局(Food and Drug Administration, FDA)作為最早開始關注組織工程醫療器械產品安全性評價和監督管理的重要性的機構,在1993年就組建了FDA組織工程工作組(Tissue Engineering Working Group, TEWG),由醫療器械和放射衛生中心(CDRH)、生物制品評價研究中心(CBER)、藥品評價研究中心(CDER)和食品安全與應用營養中心(CFSAN)共同參與組成。
2017年11月,FDA發布了監督再生醫學產品的綜合政策框架,該框架包括兩份最終指導文件和兩份指導文件草案,更清楚地描述了需要上市前授權的產品與不需要的產品之間的區別。同時,由于組織工程類產品存在多學科交叉的現象且產品類型復雜多樣,對于藥品/器械/生物制品的組合產品或管理屬性有爭議的產品,由FDA的組合產品辦公室(The Office of Combination Products, OCP)根據產品“主要作用機理”指定產品上市前負主要責任的審評機構(CDER/CDRH/CBER)。具體執行方法為:企業向OCP提交“設計文件”(Request for Designation, R&D)用以說明產品的“主要作用機理”;OCP在60天的工作時限內完成界定工作;當企業對OCP界定結果仍存爭議時,由屬性界定委員會(兩管理機構派一名代表組成)進行仲裁。
二、監管機構及法規情況
(一)監管機構對應監管的產品類型
FDA將用于植入、移植、輸液或轉移到人類接受者體內的人類細胞或組織被作為人類細胞、組織和基于細胞和組織的產品或HCT/P進行監管,主要由生物制品評估和研究中心(CBER)根據《聯邦法典》第21章第1270和1271部分對HCT/Ps進行監管。
但是,由于組織工程醫療產品的綜合性和復雜性,FDA在其官網進一步明確了CBER和CDRH的監管范圍,對于組織工程醫療產品,CDRH主要負責審評一是明確界定為醫療器械的產品;二是以器械為主的組合產品;CBER主要負責審評一是明確界定為生物制品的產品;二是以生物制品為主的組合產品;三是尚未明確界定為生物制品或醫療器械的產品。
同時,根據已有的審批情況,建立了“FDA對人類細胞、組織以及細胞和組織基產品(HCT/P’s)的監管 產品列表”,該文件旨在作為檢查工具,協助FDA調查員區分由不同結構負責監管的產品,詳見下圖。
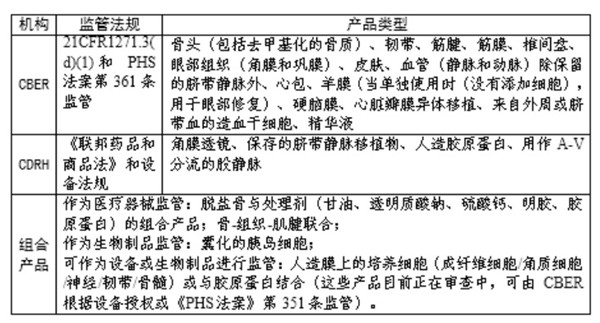
(二)監管法規情況
(1)對于組織使用監管:FDA對于組織的監管是一種基于風險的細胞和組織監管方法。監管重點在三個一般領域。1)限制傳染病從捐贈者到接受者的傳播風險;2)建立將污染風險降至最低的生產過程;3)要求對因其加工或使用而產生較大風險的細胞和組織進行適當的安全和有效性證明。符合第 1271.10 節標準的 HCT/Ps 只受《公共衛生服務法》第361節的監管。這些產品只需滿足21 CFR第1271部分的要求,而不需要獲得許可、批準或清關。對于不符合第1271.10節規定的標準的HCT/Ps,需要FDA進行上市前審查(包括許可證、批準或清關)。
(2)對于產品監管:2019年2月15日,FDA發布了兩項指南《針對嚴重疾病的再生醫學療法的快速審評計劃》和《基于再生醫學先進療法的醫療器械的評估》。這兩項指南旨在為細胞和基因療法研發人員提供新研發產品如何符合FDA快速審評計劃的明確要求。
《針對嚴重疾病的再生醫學療法的快速審評計劃》:該指南介紹了生產企業如何提供臨床證據來獲得RMAT認定,從而進入快速審評計劃,并提出研發人員可分別使用統一的規范進行加工操作,將他們的臨床數據組合在一起以支持生物制品許可證申請。快速審評計劃鼓勵生產企業在開發過程早期與CBER的組織和先進療法辦公室(OTAT)工作人員溝通,有助于生產企業和FDA工作人員討論產品的臨床前、臨床開發、化學、生產和質控等方面的問題。
《基于再生醫學先進療法的醫療器械的評估》:討論了FDA計劃如何評估基于細胞和基因治療的醫療器械。闡述了FDA將如何簡化其監管要求,并解釋了為什么基于再生醫學先進療法的醫療器械會被劃分為第三類醫療器械,以及為什么醫療器械應在其說明書或其他位置標明該器械適用于哪種特定的再生醫學療法或哪一類再生醫學療法,或者標明該產品僅限于與特定的細胞類型或多種細胞類型配合使用。
三、監管科學研究情況
通過上述介紹,FDA為更好的評估組織工程醫療產品的安全有效性,設立研究項目,開展了相應的監管科學研究工作。
(一) 通過細胞生長和成熟途徑預測用于修復受損組織和結構的細胞和組織產品的安全性和有效性。
研究問題:成功開發含有活細胞的新型生物產品的一個主要障礙是在如何測試這些產品以確保其安全和有效方面存在很大的不確定性。
研究目標:該研究的目標是確定控制細胞命運決定的關鍵信號和信號途徑,以便開發改進的方法,對實驗性細胞產品進行分析評估,既要有過程控制,又要有可靠預測產品性能的發布規范。
研究過程:FDA工作組通過開展有關實驗,已經發現了幾種作為控制細胞分化的信號的蛋白質。首先,使用各種方法確定這些信號,以及對這些途徑和它們如何控制組織和器官發育進行基于計算機的數學分析。然后,測試個別分子過度表達(分子數量過多)、在錯誤的地方表達或表達不足的影響。最終,明確信號分子的作用,以及影響關鍵環節的信息。
該研究計劃利用脊椎動物的胚胎學模型,該模型對于確定控制修復和再生的關鍵生物機制以及它們之間的相互作用特別有用。
研究成果:該研究組一是已經確定了幾個有助于控制關節形態發生、血液發育和神經系統形成等過程的分子;二是發現了在脊椎動物的關節、眼睛、甚至整個身體計劃等復雜結構的形成過程中,不同的蛋白質合作實現對組織和器官發育的精確定位控制的方式;三是確定了新的蛋白質和已知蛋白質的新功能;四是對骨形態發生蛋白和信號傳導途徑的控制提供了新的見解。其中一些分子正在被評估為治療產品、測試細胞產品的生物標志物,或用于組織工程的試劑。
(二) 開發衡量組織工程產品安全性和有效性的方法
研究問題:研究決定細胞如何成熟并有助于形成器官和組織的關鍵過程。
研究目標:識別和理解分子信號,以幫助我們預測一個細胞在被施用到病人身上后將如何發揮作用。特別是了解那些決定一個細胞是保持不成熟并繼續繁殖,還是停止分裂并成熟為在體內執行特定功能的細胞的分子信號。研究過程:工作組在轉基因小鼠模型和人類干細胞中進行研究。工作組開發了基因工程小鼠,其中這些分子可以在某些刺激下被打開或關閉。這使我們能夠研究在組織修復和器官發育過程中何時需要這些信號。由于小鼠的器官發育與人類非常相似,我們的實驗室以小鼠為模型,研究組織如何成熟以及生物信號如何決定體內細胞的命運。
四、基于FDA監管方式的思考
(一)暢通小范圍試點到正常使用注冊申報道路。FDA對于創新產品持開放的態度,在嚴重疾病或小范圍內出臺快速審批政策進行試點,然后待監管政策及技術逐步完善后再在全社會面進行推廣使用。該方式可更好的銜接創新產品成果轉化的過程,同時給企業研發創新產品帶來動力。
(二)多渠道多方式鼓勵創新產品研發。FDA對于創新產品,除通過建立基金、暢通咨詢通道外,在考慮其安全有效性的同時,充分考慮產品研發、生產等過程中可能遇到的問題,并出臺相應的鼓勵政策和實施建議,如臨床試驗階段樣本數量少可通過統一規范利用科研臨床的有關數據。該方式從多維度、多渠道切實保障創新產品研發的渠道,打通多個環節可能存在的障礙,保證創新產品順利推出。
(三)積極開展監管科學研究。當出現創新產品的時候,FDA會迅速組織有關機構開展針對創新產品的評價和測試方法的監管研究工作,在保證創新產品能盡快上市使用的同時,研發出更加快速、高效和準確的安全有效評估方法。
(文章來源:中國器審,本文章僅用于信息傳遞,不作為商業用途,如涉及侵權,請聯系我司刪除。)