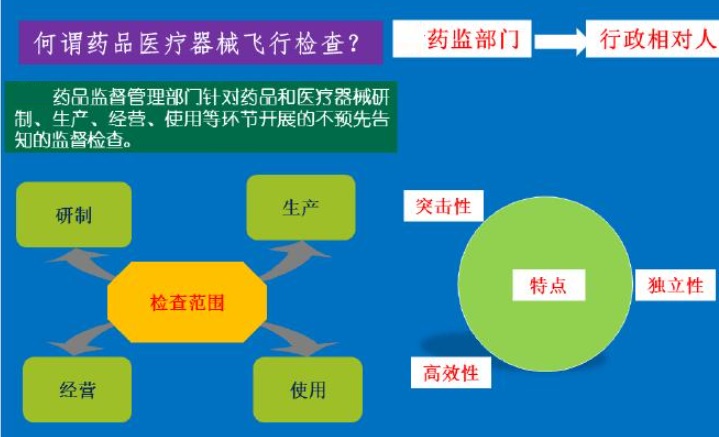
飛行檢查是藥品監管部門針對行政相對人開展的不預先告知的監督檢查,具有突擊性、獨立性、高效性等特點,目的是檢查企業醫療器械生產質量管理方面的即時 狀況或真實情況。按照政府信息公開的要求,及時向社會公布抽查結果 以及被抽查對象違法處理情況,充分發揮社會和新聞 媒體的監督作用。
飛行檢查是藥品監管部門針對行政相對人開展的不預先告知的監督檢查,具有突擊性、獨立性、高效性等特點,目的是檢查企業醫療器械生產質量管理方面的即時 狀況或真實情況。按照政府信息公開的要求,及時向社會公布抽查結果 以及被抽查對象違法處理情況,充分發揮社會和新聞 媒體的監督作用。
政策法規:2006年,國家食品藥品監管局發布了《藥品GMP飛行檢查暫行規定》,2012年發布《醫療器械生產企業飛行檢查工作程序(試行)》,在調查問題、管控風險、震懾違法行為等方面發揮了重要作用。為適應監管形勢變化和需要,經過深入調研和廣泛征求意見,總局對飛行檢查的范圍、要求、工作程序以及各方責任和義務做出進一步明確,在此基礎上,起草和制定了《藥品醫療器械飛行檢查辦法》。《辦法》共5章35條,包括總則、啟動、檢查、處理及附則。
辦法特點 :《辦法》主要體現了五大特點:一是規范飛行檢查的啟動和實施,充分體現依法獨立原則。例如,《辦法》規定了通過投訴舉報、檢驗、不良反應監測發現產品可能存在質量安全風險等可以啟動飛行檢查的七種情形。二是建立風險研判和分層處理措施,解決風險有效管控的問題。《辦法》按照風險不同分層設計了風險管控措施。例如檢查過程中,對需要立即采取暫停產品生產、銷售、使用或者召回等風險控制措施的,檢查組應當立即報請組織實施部門及時作出處理決定。三是強調全方位多層次的銜接配合,建立順暢的協調機制。《辦法》明確要求組織飛行檢查的食品藥品監督管理部門應當加強對檢查工作的指揮。可根據現場檢查反饋的情況啟動食品藥品監管相關部門的應對協調機制;可聯合公安機關等有關部門共同開展飛行檢查;可要求被檢查單位所在地食品藥品監管部門派員協助檢查。四是豐富和細化應對手段,提升飛行檢查的可操作性和權威性。例如《辦法》對被檢查單位“拒絕、逃避監督檢查”的不配合情形進行了細化,明確這些情形構成《藥品管理法實施條例》、《醫療器械監督管理條例》等有關規定的行政處罰從重情節。五是落實監管部門職責,強化執法監督。《辦法》除明確地方監管部門的協助配合義務外,還規定食品藥品監管部門應當對飛行檢查情況予以公開的原則和信息通報與報告的義務
醫療器械飛行檢查要點:
醫療器械飛行檢查的過程中發現的問題主要集中在:機構與人員管理,廠房與設施設備管理,文件管理,設計開發,采購,生產管理,質量控制管理,銷售和售后服務,不合格品控制,不良事件監測、分析和改進。
機構與人員管理主要體現在公司的架構不清晰,人員搬動沒有及時登記,關鍵崗位監管人員直至不符,人員培訓不到位,對法律法規不清楚回答不上來現場抽查人員的提問。個別與產品直接接觸人員為按要求進行年度體檢等,需要加強系統化規范性管理。廠房與設施設備管理發現的問題較多:不能夠嚴格按照生產規范GMP的要求去做,設備出現壞損不及時更換維修,廠房溫濕度,整潔度不達要求在潔凈車間洗滌間等處的水池和地漏,采用無水 封直排方式排水,難以防止微生物的侵入。倉儲區域沒有按要求進行分區管理導設置區域標識致混亂以及危險品亂放。為建立生產設備使用記錄檔案,查氣象色譜儀自帶的使用記錄有170213B-00的記錄 ,企業制訂的紙質使用記錄中未記錄上述編號記錄。
文件管理部也是企業集中出現問題的地方:
1、企業的《質量手冊》的內容按照藥品生產質量管 理規范編寫,缺少醫療器械法規及醫療器械生產質量 管理規范的要求。
2、部分生產過程的操作規程或作業指導書未按文件 要求發放到相關生產操作崗位。
3、文件更新沒有評審和批準記錄,如:納米銀醫用 抗菌敷料產品標準從2008年版升級為2016年版,未能 提供文件更新的評審和批準記錄。
4、未按文件控制程序的要求更新外來文件《醫療器 械監督管理條例》(國務院令第680號)、《醫療器 械召回管理辦法》(局令第29號)等。
5、原材料檢驗記錄存在隨意涂改的現象。
6、產品生產相關記錄未逐臺進行歸檔,不易檢索。
生產管理環節是企業最重要的一個環節也是最容易出現問題的地方,生產過程中的細節以及操作是否規范決定了產品的最終質量,也決定了公司的未來以及存亡。
問題主要集中在:企業提供的生產工藝流程未有效識別關鍵工序和 特殊過程,并進行有效管理,驗證或確認報告不能有 效指導操作。現場檢查半成品 ,生產隨工卡空白,沒有按生產進程記。生產記錄缺少原材料分子篩批號、主要設備等內容。企業生產記錄相關規程中只明確了產品機身號的 編碼規則,未明確生產日期如何確定,也未明確生產 日期和機身碼之間的關聯。
生產記錄無產品規格型號、數量、生產日期等; 生產記錄中調試工序相關記錄信息不全,未包含主要 設備、工藝參數等內容。企業實施受控的《產品批號管理規定》未詳細對 產品的滅菌批號編制方法進行規定。生產管理環節的不規范跟質量控制脫不了關系:企業制定的檢驗規程及檢驗記錄與產品注冊標準 中規定不一致,未建立質控品臺賬,只有使用記錄,未記錄來源 和效期等信息。試驗用朗道常規校準物使用記錄中無保存溫度和 過期產品處理記錄。如:生產設備“精密擠出機”的溫控儀校準證已過期,未定期校準。— 8.3.1 企業成品檢驗報告未包含產品注冊標準中出廠檢 驗項目的相關內容等。所以做好質量管控關卡保證生產過程的規范是做好產品的前提。
銷售以及售后服務方面也是極易出現問題的地方
主要體現在資料的不完成:1、銷售記錄無產品名稱、生產批號、購貨單位、地 址、聯系方式等內容,產品銷售記錄缺項多,不能滿 足追溯要求。2、銷售記錄缺少產品編號或序列號、有效期、銷售 日期、聯系方式等內容。3、企業未建立經銷商管理規程,未規定應查驗經銷 商(顧客)的資質文件,并由企業法規部門參與評審 經銷商訂單(正常或特殊規格)的合法合規性。所以一定要做好銷售環節的審查與監管工作,確保能夠及時清晰有效的追蹤溯源,確保流通環節的透明清晰。
處罰不是目的,而是為了讓企業繃緊合規守法的那根弦,把患者的利益放在第一位。隨著國家的監管力度逐漸加大,飛檢也將成為常態化這就企業從細微做起嚴格按照GMP規范要求去做合格的產品,有社會責任感和有擔當的企業。
標簽:醫療器械飛行檢查要點