- 聯系我們

聯系電話:0571-86198618手機: 18058734169 (微信同)手機:18868735317(微信同)周一至周日 8:00~22:00
在線客服周一至周日 8:00~22:00
引言:醫用呼吸道濕化器一般由主機、貯水箱和一些附件組成,是用于濕化輸送給患者的呼吸氣體的醫用電氣設備,通常與呼吸治療設備配合使用。按照我國醫療器械分類規則,醫用呼吸道濕化器產品屬于第二類醫療器械注冊產品,分類編碼為08-05-02。
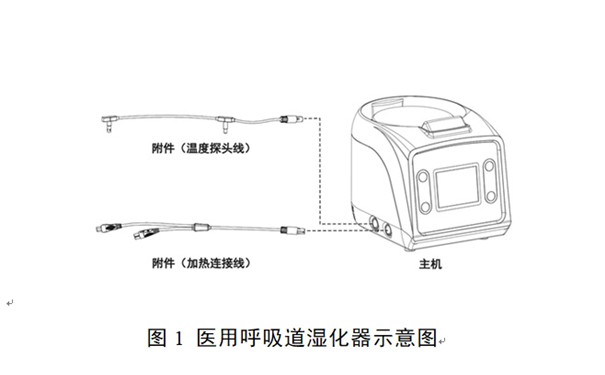
一、醫用呼吸道濕化器注冊流程:
醫用呼吸道濕化器注冊單元劃分:注冊單元按照《醫療器械注冊單元劃分指導原則》的要求,原則上以產品的技術原理、結構組成、性能指標和適用范圍為劃分依據。
加熱濕化控制技術原理差別較大的產品,建議劃分為不同的注冊單元。貯水箱、氣體溫度傳感器、加熱連接線等部件可以和主機劃分為同一個注冊單元。
醫用呼吸道濕化器注冊產品按照國產第二類醫療器械申報流程,注冊流程如下:
前期準備(廠房裝修、工藝布局、設備配置、產品研發定型、實驗室建設)——建立醫療器械質量管理體系——注冊檢測——臨床評價——注冊申請——技術審評(省藥監局)——醫療器械注冊質量管理體系核查——審評發補補正&體考不符合整改——行政許可——取得醫療器械產品注冊證——申請醫療器械生產許可證——取得醫療器械生產許可證。
二、第二類醫療器械注冊費用:
醫用呼吸道濕化器作為第二類醫療器械注冊產品,注冊費用主要包括企業自身為具備醫療器械生產和產品研發、制造產生的費用;醫療器械注冊檢驗及臨床評價需要的費用;醫療器械注冊審評費用;及第三方醫療器械咨詢服務公司收取的咨詢輔導費用。
三、醫用呼吸道濕化器注冊審評要點:
1..適用范圍、禁忌證
1.1適用范圍
產品用于濕化輸送給患者的呼吸氣體。
適用人群:視產品設計,可以用于成人、兒童、嬰兒等。
適用環境:明確產品的使用場所,如醫院、家庭等使用場所。
如果產品可以在特殊環境使用,也應進一步說明,如急救轉運、高海拔條件下使用等。
1.2禁忌證:暫未發現。
2.產品技術要求應包括的主要性能指標
不同的醫用呼吸道濕化器產品其參數根據設計要求會有所區別。本指導原則列出此類產品可能涉及的重要性能參數,注冊申請人可根據自身產品的技術特點制定性能指標的具體要求。若企業宣稱產品還具有其他工作模式應同時考慮制定相應的性能和功能要求。
2.1主機技術指標要求
以下指標依據YY 9706.274標準要求列出,若標準更新,申請人應引用當下現行標準。申請人要求若高于標準可按申請人要求執行。
2.1.1氣體流量范圍及濕化輸出:應明確不同條件下的氣體流量范圍及對應的氣體濕化輸出;
2.1.2被測氣體溫度監護裝置:溫度顯示范圍:至少為25-45℃,精度:≤±2℃;
2.1.3運行噪音(距設備1米):≤50dB(A);
2.1.4操作者可設置參數:應明確操作者可設置的參數,預期用于有創通氣治療的至少應包括患者端氣體溫度設置;
2.1.5參數鎖定功能(如適用):包括輸送氣體溫度鎖定;
2.1.6預熱時間:應明確最大預熱時間;
2.1.7報警裝置(如適用):如患者端超溫報警、患者端低溫報警、患者端低濕度報警、水量低報警或缺水報警、主機加熱模塊超溫報警,應符合YY 9706.108的規定。
2.2貯水箱性能指標要求(如有)
2.2.1貯水容量
應明確最大水位線的容量;
2.2.2接頭
圓錐接頭應符合YY/T 1040.1接頭要求;
2.2.3最大承受壓力
應明確最大承受壓力,持續3min,應無開裂現象;
2.2.4液體密封性
加水至最大水位線時,加入最大承受氣壓,應無滲漏現象;
2.2.5無菌或微生物限度
若出廠是為無菌狀態,則應制定無菌指標。使用前無需清潔、消毒的非無菌使用產品,應對其微生物限度進行評價,同時可參考《中華人民共和國藥典》中微生物限度藥典檢查法進行檢測;
環氧乙烷殘留量:若經環氧乙烷滅菌,則環氧乙烷殘留量指標應符合GB/T 16886.7的要求;
微生物限度限值要求:使用前無需清潔、消毒的非無菌使用產品,不得檢出大腸菌群、致病性化膿菌;細菌總數應≤200cfu/g、真菌菌落總數≤100cfu/g。
2.3軟件功能
應符合《醫療器械軟件注冊審查指導原則》中第九章注冊申報資料補充說明中關于產品技術要求性能指標的建議內容。
2.4安全要求
產品應符合GB 9706.1、YY 9706.274、YY 9706.102、YY 9706.108(如有)標準的要求。
對于預期在家庭環境或其他非專業醫療環境下使用的設備,應符合YY 9706.111標準的要求。
3.同一注冊單元內檢驗典型性產品確定原則
3.1典型產品應是同一注冊單元內能夠代表本單元內其他產品安全性和有效性的產品。
3.2產品的加熱濕化控制、濕化罐結構設計等因素決定了產品的性能,如果前述因素差別較大,應分別進行驗證。
