2023年4月28日,國家藥監局發布《應用納米材料的醫療器械安全性和有效性評價指導原則第二部分:理化表征》,本指導原則為注冊申請人/監管人員提供關于應用納米材料的醫療器械理化表征相關方面的信息。本指導原則是對應用納米材料醫療器械理化表征的一般要求,醫療器械注冊申請人應依據具體產品的特性對注冊申報資料的內容進行充分說明和細化。
應用納米材料的醫療器械安全性和有效性評價指導原則第二部分:理化表征
本指導原則為注冊申請人/監管人員提供關于應用納米材料的醫療器械理化表征相關方面的信息。
本指導原則是對應用納米材料醫療器械理化表征的一般要求,醫療器械注冊申請人應依據具體產品的特性對注冊申報資料的內容進行充分說明和細化。注冊申請人還應依據具體產品的特性確定其中的相關內容是否適用,若不適用,需詳細闡述理由及相應的科學依據。
本指導原則是對醫療器械注冊申請人和審評人員的指導性文件,但不包括注冊審批所涉及的行政事項,亦不作為法規強制執行,如果有能滿足相關法規要求的其它方法,也可以采用,但是需要提供詳細的研究資料和驗證資料。應在遵循相關法規的前提下使用本指導原則。
本指導原則是在現行法規和標準體系以及當前認知水平下制定的,隨著法規和標準的不斷完善,以及科學技術的不斷發展,本指導原則相關內容也將進行適時的調整。
一、適用范圍
本指導原則適用于與人體直接或間接接觸,由納米材料組成或包含納米材料的醫療器械的理化表征。
不適用于:
- 應用納米材料的體外診斷產品;
- 應用納米材料的藥品;
- 納米技術賦能的醫療產品(如納米機器人);
- 應用納米材料的醫療器械在制造和廢棄過程中造成的職業和環境風險。
二、理化表征在應用納米材料的醫療器械申報資料中的體現
應用納米材料的醫療器械產品的安全性和有效性與所使用的納米材料的理化性質(如化學組成、尺寸及尺寸分布、形態學、表面特性等)緊密相關。根據國家藥品監督管理局發布的《關于公布醫療器械注冊申報資料要求和批準證明文件格式的公告》,理化表征在應用納米材料的醫療器械產品安全性和有效性評價的意義和作用主要體現在以下申報資料中:
(一)監管信息(委托信息、主文檔授權信)
應用納米材料的醫療器械產品注冊申請人可自行獨立研發、或委托第三方研發納米原材料,或直接外購納米原材料。注冊申請人應具備對于納米原材料的完整評價和供應商審核能力,并證明其對醫療器械終產品生產關鍵工藝及參數進行質量控制的能力。因此,如果醫療器械的原材料為納米材料,注冊申請人應提供包括納米原材料的理化表征在內的質量控制文件。如果委托其他企業生產的,應當提供受托企業資格文件、委托合同和質量協議。在質量協議中,應提供納米材料質量控制相關參數。如果原材料供應商已在國家藥品監督管理局醫療器械技術審評中心進行過主文檔備案,應提交主文檔授權信。
(二)研究資料(產品化學和物理性能研究)
注冊申請人在設計應用納米材料的醫療器械時,預期利用納米材料的某些特殊性能,如小尺寸、高比表面積、高化學活性,或者利用納米表面特性對于體內微環境的影響來發揮其功能。如納米銀敷料利用了納米銀在一定時期內可持續釋放銀的特性。又如某些骨科植入物表面納米結構的設計,可以促進骨重建過程。為證明產品中所設計應用的納米材料能夠發揮預期特性,注冊申請人需開展有針對性的理化性質表征。這些研究也將成為確定產品技術要求中科學合理的性能指標和檢驗方法的關鍵依據。
(三)研究資料(產品生物學特性研究)
現行的GB/T 16886.1(ISO 10993.1)將理化表征作為醫療器械生物相容性評價的起點。對于應用納米材料的醫療器械,這一點尤為重要,因納米材料的生物學效應取決于其理化性質,如尺寸及尺寸分布、形態學、表面特性、化學組成、團聚/聚集狀態等。在生物相容性/毒理學研究過程中,注冊申請人不僅要對醫療器械產品中的納米材料開展理化表征,而且根據風險分析,確定是否需要針對在生物組織/體液中的納米材料及其代謝/轉歸產物開展理化表征。客觀、真實的定性/定量理化表征結果,可為開展生物相容性/毒理學研究提供必要的信息。相反,非客觀、真實的定性/定量理化表征結果,可能導致對于產品安全性風險的錯誤判定。
(四)研究資料(清潔、消毒、滅菌研究)
在應用納米材料的醫療器械生產工藝過程中,作為原材料之一的納米材料通常經過多道工藝過程,生產工藝過程對于終產品中納米材料存在狀態的影響,以及產品的批間/批內穩定性和均一性需要通過充分的理化表征來證明。
建議注冊申請人在滅菌方法驗證中對于納米材料特性加以考慮,如:輻照劑量對于納米材料是否存在影響,環氧乙烷是否會殘留在納米材料結構中難以解析等。此外,注冊申請人在考慮對于驗證所需產品批次和樣本量的要求時,也需要通過理化表征對于納米材料在醫療器械中分布的均勻性等因素進行研究分析。
(五)研究資料(穩定性研究)
理化表征同樣對于產品貨架有效期和包裝驗證非常重要。目前,產品有效期驗證所采用的加速老化計算依據仍是根據傳統高分子材料總結的阿累尼烏斯(Arrhenius)反應公式,該公式是否適用于納米材料仍有待深入研究。因此,建議注冊申請人在有效期各時間點應針對納米材料開展適宜的理化表征,以證明醫療器械中的納米材料是否在儲存期內發生物理性質和化學性質的變化。
(六)產品臨床評價資料
目前,應用納米材料的醫療器械臨床評價尚缺乏相應的指導原則/審評要點。注冊申請人應根據申報產品的適用范圍、技術特征、已有臨床數據等具體情況,選擇恰當的臨床評價路徑,包括“同品種臨床評價路徑”和/或“臨床試驗路徑”。若注冊申請人通過同品種臨床評價路徑進行臨床評價,除了提交申報產品與同品種醫療器械在適用范圍、技術特征、生物學特性方面的對比資料,注冊申請人還需開展具有針對性和特異性的完整而全面的理化表征研究,這對于確定對照產品是否為同品種產品是至關重要的。
三、納米材料理化性質表征的基本原則
納米材料尺寸小、比表面積大、化學活性高,在不同環境中表面特性和聚集狀態易發生變化,這給納米材料的生物學效應評估帶來挑戰。針對應用納米材料的醫療器械開展全面而準確的理化性質表征以及使用過程中納米材料理化性質變化測量都至關重要。應用納米材料的醫療器械的理化表征流程圖可以參考圖1a。根據產品及納米材料的性質,可以選擇不同階段的理化檢測項目,流程圖1b中給出了檢測項目示例。該理化表征可分為三個層次:納米原材料、醫療器械終產品中的納米材料、生物組織樣本中的納米材料(僅適用于生物組織吸收了應用納米材料的醫療器械釋放的納米材料;或者應用納米材料的醫療器械中的納米材料釋放并遷移到了生物組織樣本中)。
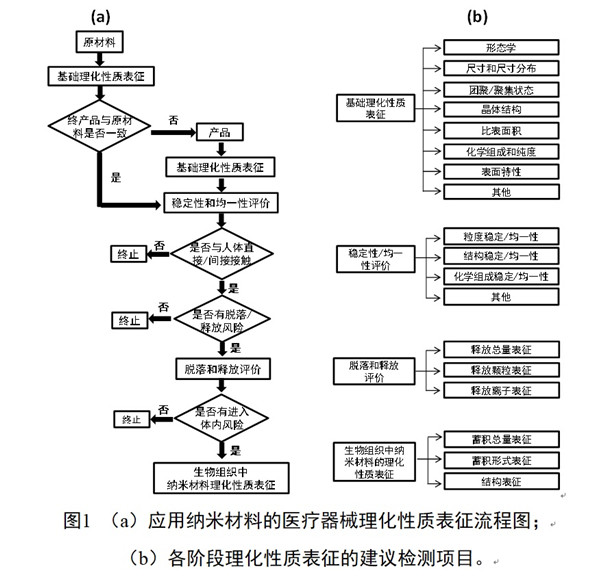
開展應用納米材料醫療器械理化表征的第一步是對作為醫療器械生產的起始納米原材料和終產品中的納米材料進行理化表征,包括形態學、尺寸、團聚/聚集狀態、晶體結構、比表面積、化學組成與純度、表面特性等。通過同時表征的數據證明起始原料的表征數據與終產品中應用的納米材料是否相同。如果相同或者有數據闡明相似的材料具有足夠相似的理化性質,可以考慮采用這些數據來進行產品的風險評估。如果不同,則應以終產品的詳細表征數據為基礎進行風險評估。為了確保在同一工藝參數下,產品的質量差異在可接受的偏差范圍內,注冊申請人需對產品中的納米材料進行明確的穩定性和均一性評價。評價內容包括儲存、運輸、使用等過程中,納米材料受環境等因素影響,隨時間推移造成的幾何形態學、尺寸、聚集狀態、化學成分、氧化狀態等理化性質的變化。
需要強調的是,納米材料可能在加工過程中改變其表面化學,比如獲得新的或額外的表面分子,作用類似于涂層;或者氧化狀態改變等。鑒于這些潛在的表面改變,如有必要,注冊申請人應考慮納米材料在測試和/或使用的不同階段開展理化性質表征。
對于與人體有直接或間接接觸的醫療器械,納米材料的脫落和釋放風險是必須要考慮的。游離的納米材料或釋放的離子進入體內是可能引起在個體水平、組織水平以及細胞和分子水平上不良反應的關鍵因素。因此需要根據納米材料脫落/釋放的風險評估,對可能暴露的納米材料進行分析與理化表征,包括測量釋放元素的種類與釋放元素總量,以及測量釋放液中可能存在的納米顆粒以及離子濃度。需要指出的是:納米材料的脫落和釋放評價不僅限于體外評價,如適用,鼓勵注冊申請人同時開展體外和體內納米材料脫落和釋放評價研究,并將體外和體內研究結果相關聯。
產品使用過程中脫落或釋放的納米材料,以及由納米材料釋放的離子可隨血液系統或淋巴系統進入體內循環,并在組織器官中蓄積。納米材料在生物組織中的蓄積量、存在形式(顆粒或其降解產物)以及材料結構是否出現缺陷決定了其在體內的穩定性和潛在的生物安全性。因而如果從產品中脫落/釋放的納米材料有進入體內循環系統的風險,則有必要提供生物組織中納米材料的蓄積量數據,并證實其存在形式、結構等理化性質。
如本指導原則第二部分所述,在原材料質控、產品有效性研究、產品安全性研究、產品生產工藝和質量控制研究,以及產品臨床評價中,需要針對不同樣本中的納米材料進行適宜的理化表征。注冊申請人、科研人員、檢測人員,以及審評人員應當認識到,只有采用適合產品特點,并能最大限度保持或模擬產品與人體接觸暴露環境的理化表征手段,且試驗人員和評價人員具備足夠的納米材料相關知識的前提下,理化表征結果才能用于正確評價應用納米材料的醫療器械安全性和有效性。
例如,在開展納米銀敷料類產品理化表征時,應在總銀含量和可溶性銀含量的測定研究中,正確區分離子形式的銀和納米顆粒狀態的銀,同時需要區分銀的價態。目前,測定總銀含量的主流方法是經硝酸消解后采用ICP-MS方法分析。注冊申請人應考慮將經驗證的單顆粒ICP-MS、同步輻射方法、光電子能譜(XPS)、高光譜成像方法等,用于實際納米銀敷料產品的研究,以便區分釋放的銀是離子狀態還是顆粒狀態,以及銀的價態,同時借助原位、無損、高靈敏度的分析方法來明確生物轉運過程中銀的化學性質轉化,探討生物體銀的化學性質信息與生物效應的關系。
前期研究工作已證實納米材料有可能與蛋白質相互作用,形成蛋白冠,影響納米顆粒的各種生物學效應。在銀的釋放試驗中,如果僅采用簡單體外模型,例如采用不含蛋白的純水、PBS或生理鹽水研究銀的釋放/溶出,則無法反映臨床使用中實際創面及其滲出液存在蛋白或其他成分的復雜情況,特別是形成蛋白冠現象,應考慮這一因素對于產品中銀的釋放/溶出,以及進入體內的行為和生物學效應的影響。
應用納米材料的醫療器械理化表征和測量方法示例見附件1的表1,該表內容主要來源于GB/T 39261(ISO/TR 13014),以及ISO/TR 10993.22。注冊申請人應根據產品及納米材料特性選擇適合的理化表征方法組合。此外,如有必要,注冊申請人也應提供該表之外檢測方法獲得的額外信息以便進行風險評估。需要指出的是,當前大多數納米材料理化表征方法是針對科研或工業中應用的納米材料制訂的,并未采用實際醫療器械產品進行過納米材料表征或者生物樣本中納米材料表征的驗證和優化。因此,注冊申請人在采用相關標準方法開展理化表征研究時,需對所采用的方法是否適用于應用納米材料的醫療器械進行驗證,充分考慮所采用的方法中不適用部分的改進和優化。
四、現行可用標準簡介
目前,針對納米材料或納米技術的國內標準(包括國家標準、行業標準、地方標準、團體標準)有近200個。其中涉及理化表征的技術方法類或指南類標準約有100個,均可選擇性地被用于應用納米材料的醫療器械理化表征檢測。另外,還有很多并非針對納米材料或納米技術的方法標準也可用于應用納米材料的醫療器械理化表征檢測。附件1的表1中盡可能收集了納米材料理化表征相關的標準。但注冊申請人、檢測機構,以及審評部門應根據應用納米材料的醫療器械預期用途、結構組成、作用機理、與人體的暴露途徑/時間、納米材料在醫療器械中的存在形式等因素,綜合考慮上述標準是否適用于醫療器械中的納米材料表征。
目前,國家藥監局已發布了三項專門針對應用納米材料的醫療器械行業標準,分別是YY/T 1295《醫療器械生物學評價 納米材料:細菌內毒素試驗》、YY/T 0993《醫療器械生物學評價 納米材料:體外細胞毒性試驗(MTT試驗和LDH試驗)》,以及YY/T 1532《醫療器械生物學評價 納米材料 溶血試驗》,其中都涉及到對于納米材料理化表征的相關要求。YY/T 1863《納米醫療器械生物學評價 含納米銀敷料中銀顆粒和銀離子的釋放與表征方法》行業標準即將發布,該標準給出了具體的釋放試驗方法與表征方法。
此外,已發布的GB/T 38261《納米技術 生物樣品中銀含量測量 電感耦合等離子體質譜法》標準適用于各種生物組織中銀含量的定量測量。
五、縮略語和術語表
縮略語/術語 | 英文全稱 | 解釋 |
AES | auger electron spectroscopy | 俄歇電子能譜法 |
AFM | atomic force microscopy | 原子力顯微鏡法 |
AUC | analytical ultracentrifugation | 分析型超速離心 |
BET | Brunner?Emmet?Teller method | 比表面積測量:旨在解釋氣體分子在固體表面的物理吸附的布魯諾-艾默特-泰勒(BET)理論 |
CLS | centrifugal liquid sedimentation | 液體離心沉降 |
DLS | dynamic light scattering | 動態光散射是在一個系綜中測量顆粒粒徑分布的方法 |
DMA | differential mobility analysis | 微分遷移率分析 |
EDS | energy dispersive X-ray spectroscopy | 能量色散X射線光譜,可分析小至幾納米直徑的顆粒 |
EELS | electron energy loss spectroscopy | 電子能量損失譜,可分析小至幾納米直徑的顆粒 |
EFSA | European Food Safety Authority | 歐洲食品安全局 |
ESEM | environmental scanning electron microscopy | 環境掃描電子顯微鏡法 |
FTIR | Fourier transform infrared spectroscopy | 傅里葉變換紅外光譜法 |
IR | infrared absorption spectrum | 紅外吸收光譜 |
ICP-MS | inductively coupled plasma mass spectrometry | 電感耦合等離子體質譜法 |
ICP-OES | inductively coupled plasma-optical emission spectrometry | 電感耦合等離子體發射光譜法 |
LII | laser induced incandescence | 激光誘導白熾光 |
MFS | molecular fluorescence spectroscopy | 分子熒光光譜 |
MS | mass spectrometry | 質譜法 |
NMR | nuclear magnetic resonance | 核磁共振 |
PTA | particle tracking analysis | 顆粒跟蹤分析 |
SAXS | small angle X-ray scattering | 小角X射線散射 |
SCCS | Scientific Committee on Consumer Safety | 消費者安全科學委員會 |
SEC | size exclusion chromatography | 尺寸排阻色譜 |
SEM | scanning electron microscope | 掃描電子顯微鏡法 |
SIMS | secondary ion mass spectrometry | 二次離子質譜法 |
spICP-MS | single particle inductively coupled plasma mass spectrometry | 單顆粒電感耦合等離子體質譜法 |
SPM | scanning probe microscopy | 掃描探針顯微鏡法 |
STM | scanning tunneling microscopy | 掃描隧道顯微鏡法 |
TEM | transmission electron microscopy | 透射電子顯微鏡法 |
TG | thermogravimetric analysis | 熱重分析 |
USAXS | ultrasmall angle X-ray scattering | 超小角X射線散射 |
UV-Vis | ultraviolet–visible spectroscopy | 紫外可見光譜 |
XPS | X-ray photoemission spectroscopy | X射線光電子能譜,也稱為ESCA |
XRD | X-ray diffraction | X射線衍射 |
XRF | X-ray fluorescence spectrometry | X射線熒光光譜 |
XAFS | X-ray absorption fine structure | X射線吸收精細結構譜 |
納米物體 | nano-object | 一維、二維或三維外部維度處于納米尺度的物體。注:用于所有相互分離的納米尺度物體的通用術語。(GB/T 30544.1) |
納米顆粒 | nanoparticle | 三個維度的外部尺寸都在納米尺度的納米物體,其最長軸和最短軸的長度沒有明顯差別。注:如果納米物體最長軸和最短軸的長度差別顯著(大于3倍)時,應用納米棒、納米纖維或納米片來表示納米顆粒。(GB/T 32269-2015) |
納米尺度 | nanoscale | 處于1 nm至100 nm之間的尺寸范圍(GB/T 30544.1) |
納米結構材料 | nanostructure material | 內部或表面具有納米結構的材料。(GB/T 30544.1) |
六、參考文獻
[1]GB/Z 16886.22-2022(ISO/TR 10993.22:2017,IDT),醫療器械生物學評價-第22部分:納米材料指南[S].
[2]GB/T 39261-2020,納米技術 納米材料毒理學評價前理化性質表征指南[S].
[3]國家藥品監督管理局.醫療器械注冊申報資料要求和批準證明文件格式:國家局公告2021年第121號[Z].
[4]GB/T 38261-2019,納米技術 生物樣品中銀含量測量 電感耦合等離子體質譜法[S].
[5]ISO/TR 13014:2012,納米技術——工程納米材料理化特性毒理學評估指南Nanotechnologies-Guidance on physico-chemical characterization of engineered nanoscale materials for toxicologic assessment[S].
[6]GB/T 21649.1-2008,粒度分析 圖像分析法 第1部分:靜態圖像分析法[S].
[7]GB/T 15445.6-2014,粒度分析 結果的表述 第6部分:顆粒形狀和形態的定性及定量表述[S].
[8]GB/T 27788-2020,微束分析 掃描電鏡 圖像放大倍率校準導則[S].
[9]ISO 21363:2020, Nanotechnologies - Measurements of particle size and shape distributions by transmission electron microscopy[S].
[10]ISO 19749:2021, Nanotechnologies - Measurements of particle size and shape distributions by scanning electron microscopy[S].
[11]JY/T 0582-2020,掃描探針顯微鏡分析方法通則[S].
[12]ISO/TS 19590:2019, Nanotechnologies - Size distribution and concentration of inorganic nanoparticles in aqueous media via single particle inductively coupled plasma mass spectrometry[S].
[13]GB/T 29022-2021,粒度分析 動態光散射法(DLS)[S].
[14]GB/T 19627-2005,粒度分析 光子相關光譜法[S].
[15]GB/T 20307-2006,納米級長度的掃描電鏡測量方法通則[S].
[16]GB/T 30543-2014,納米技術 單壁碳納米管的透射電子顯微術表征方法[S].
[17]ISO 19430:2016, Particle size analysis Particle tracking analysis (PTA) method[S].
[18]ISO 13318, Determination of particle size distribution by centrifugal liquid sedimentation methods系列標準[S].
[19]GB/T 19077-2016,粒度分析 激光衍射法[S].
[20]GB/T 32871-2016,單壁碳納米管表征 拉曼光譜法[S].
[21]GB/T 29024,粒度分析 單顆粒的光學測量方法 系列標準[S].
[22]GB/T 41316-2022,分散體系穩定性表征指導原則[S].
[23]GB/T 38431-2019,顆粒分散體系穩定性評價 靜態多重光散射法[S].
[24]GB/T 19587-2017,氣體吸附BET法測定固態物質比表面積[S].
[25]GB/T 39713-2020,精細陶瓷粉體比表面積試驗方法 氣體吸附BET法[S].
[26]GB/T 21650,壓汞法和氣體吸附法測定固體材料孔徑分布和孔隙度 系列標準[S].
[27]GB/T 17359-2012,微束分析 能譜法定量分析[S].
[28]GB/T 30703-2014,微束分析 電子背散射衍射取向分析方法導則[S].
[29]GB/T 28634-2012,微束分析 電子探針顯微分析 塊狀試樣波譜法定量點分析[S].
[30]GB/T 25189-2010,微束分析 掃描電鏡能譜儀定量分析參數的測定方法[S].
[31]GB/T 30543-2014,納米技術 單壁碳納米管的透射電子顯微術表征方法[S].
[32]GB/T 36065-2018,納米技術 碳納米管無定形碳、灰分和揮發物的分析 熱重法[S].
[33]GB/T 30903-2014,無機化工產品 雜質元素的測定 電感耦合等離子體質譜法(ICP-MS)[S].
[34]GB/T 38261-2019,納米技術 生物樣品中銀含量測量[S].
[35]GB/T 38789-2020,口腔清潔護理用品 牙膏中10種元素含量的測定 電感耦合等離子體質譜法[S].
[36]GB/T 25185-2010,表面化學分析 X射線光電子能譜 荷電控制和荷電校正方法的報告[S].
[37]GB/T 26533-2011,俄歇電子能譜分析方法通則[S].
[38]GB/T 29558-2013,表面化學分析 俄歇電子能譜 強度標的重復性和一致性[S].
[39]GB/T 29556-2013,表面化學分析 俄歇電子能譜和X射線光電子能譜 橫向分辨率、分析面積和分析器所能檢測到的樣品面積的測定[S].
[40]GB/T 30702-2014,表面化學分析 俄歇電子能譜和X射線光電子能譜 實驗測定的相對靈敏度因子在均勻材料定量分析中的使用指南[S].
[41]GB/T 28893-2012,表面化學分析 俄歇電子能譜和X射線光電子能譜 測定峰強度的方法和報告結果所需的信息[S].
[42]GB/Z 32494-2016,表面化學分析 俄歇電子能譜 化學信息的解析[S].
[43]GB/T 24581-2022,硅單晶中III、V族雜質含量的測定 低溫傅立葉變換紅外光譜法[S].
[44]GB/T 39114-2020,納米技術 單壁碳納米管的紫外/可見/近紅外吸收光譜表征方法[S].
[45]JY/T 022-1996,紫外和可見吸收光譜方法通則[S].
[46]GB/T 19502-2004,表面化學分析 輝光放電發射光譜方法通則[S].
[47]GB/T 30902-2014,無機化工產品 雜質元素的測定 電感耦合等離子體發射光譜法(ICP-OES)[S].
[48]GB/T 33324-2016,膠乳制品中重金屬含量的測定 電感耦合等離子體原子發射光譜法[S].
[49]GB/T 30905-2014,無機化工產品 元素含量的測定 X射線熒光光譜法[S].
[50]JY/T 0573-2020,激光拉曼光譜分析方法通則[S].
[51]GB/T 29858-2013,分子光譜多元校正定量分析通則[S].
[52]JY/T 0578-2020,超導脈沖傅里葉變換核磁共振波譜測試方法通則[S].
[53]DB46/T 520-2020,全生物降解塑料制品 核磁共振波譜快速檢測法[S].
[54]GB/T 33523-2017,產品幾何技術規范(GPS) 表面結構 區域法 系列標準[S].
[55]GB/T 33498-2017,表面化學分析 納米結構材料表征[S].
[56]GB/T 28894-2012,表面化學分析 分析前樣品的處理[S].
[57]GB/T 40109-2021,表面化學分析 二次離子質譜 硅中硼深度剖析方法[S].
[58]GB/T 25186-2010,表面化學分析 二次離子質譜 - 由離子注入參考物質確定相對靈敏度因子[S].
[59]GB/T 32671,膠體體系 zeta電位測量方法 系列標準[S].
[60]GB/T 41316-2022,分散體系穩定性表征指導原則[S].
[61]GB/T 38431-2019,顆粒 分散體系穩定性評價 靜態多重光散射法[S].
[62]歐盟新興與新識別健康風險委員會(SCENIHR),醫療器械中應用的納米材料潛在健康效應指導原則 Guidance on the Determination of Potential Health Effects of Nanomaterials Used in Medical Devices,Scientific Committee on Emerging and Newly Identified Health Risks[Z]. 2015
[63]THE U.S. FOOD AND DRUG ADMINISTRATION. Nanotechnology—Over a Decade of Progress and Innovation, 2020[R].
[64]G.A.Martínez-Castaón, F.Martínez-Gutiérrez, F.Ruiz, et al. Characterization and biocompatibility of chitosan gels with silver and gold nanoparticles[J]. J Nanomater, 2014, 543419.
[65]Harada Masafumi, Yamamoto Miho, Iwase Hiroki. Combined small-angle neutron scattering/small-angle X?ray scattering analysis for the characterization of silver nanoparticles prepared via photoreduction in water-in-oil microemulsions[J]. Langmuir 2021, 37:13085?13098.
[66]J Liu,KE Murphy,RI Maccuspie, et al. Capabilities of single particle inductively coupled plasma mass spectrometry for the size measurement of nanoparticles: a case study on gold nanoparticles[J]. Anal. Chem. 2014, 86:3405–3414.
[67]DE Gorka, NJ Lin, JM Pettibone, et al. Chemical and physical transformations of silver nanomaterial containing textiles after modeled human exposure[J]. NanoImpact. 2019, 14C:100160.
[68]Wang Liming, Zhang Tianlu Li Panyun, et al. Use of Synchrotron Radiation-Analytical Techniques To Reveal Chemical Origin of Silver-Nanoparticle Cytotoxicity[J]. ACS Nano 2015, 9:6532-6547.
[69]YY/T 1295-2015,醫療器械生物學評價 納米材料:細菌內毒素試驗[S].
[70]YY/T 0993-2015,醫療器械生物學評價 納米材料:體外細胞毒性試驗(MTT試驗和LDH試驗)[S].
[71]YY/T 1532-2017,醫療器械生物學評價 納米材料 溶血試驗[S].
[72]YY/T 1863-2023,納米醫療器械生物學評價 含納米銀敷料中銀顆粒和銀離子的釋放與表征方法[S].
七、編寫單位
本指導原則由國家藥品監督管理局醫療器械技術審評中心牽頭,國家納米科學中心、中國食品藥品檢定研究院參與編寫,由國家藥品監督管理局醫療器械技術審評中心負責解釋。