- 聯系我們

聯系電話:0571-86198618手機: 18058734169 (微信同)手機:18868735317(微信同)周一至周日 8:00~22:00
在線客服周一至周日 8:00~22:00
經鼻膽汁外引流管在我國屬于第二類醫療器械注冊產品,通常由管體和接頭組成,有的根據需要配有鼻轉換管、連接管或三通閥、矯直管等。產品與內窺鏡配合使用,通過口鼻進入膽管,用于膽汁引流,屬于一次性使用無菌產品。
經鼻膽汁外引流管注冊要求及審查要點:
1.醫療器械注冊單元劃分
根據《醫療器械分類目錄》,經鼻膽汁外引流管,分類編碼為14注輸、護理和防護器械-05非血管內導(插)管-06引流導管。
按照《醫療器械注冊單元劃分指導原則》,注冊單元劃分著重考慮產品的技術原理、結構組成、性能指標及適用范圍等因素。
對于配合使用、以完成同一手術/護理目的的工具組合可以作為同一注冊單元進行申報。引流管(含接頭)、連接管、鼻轉換管可作為經鼻膽汁外引流管的組成進行申報。
產品結構組成不同而導致產品性能指標不同時,原則上劃分為不同注冊單元,如新型的結構設計和本指導原則中提及的傳統結構設計不宜放在同一注冊單元。
2.產品的適用范圍/預期用途、禁忌證
產品的適用范圍應與申報產品的性能、功能相符。
適用范圍:
產品與內窺鏡配合使用,經過鼻腔進行膽汁的引流。
禁忌證同經內鏡鼻膽管引流術(ENBD)的禁忌證。
3.產品技術要求
根據產品的主要功能和預期用途,產品的技術指標主要包括產品的外觀、尺寸、物理性能、化學性能和無菌性能。不同企業的產品參數根據設計要求可有所區別,并可根據自身產品的技術特點制訂性能指標要求,但不得低于相關強制性國家標準、行業標準的要求。
3.1形狀尺寸要求
3.1.1外觀:引流管(尤其是頭端)的相關要求。
3.1.2尺寸及形狀
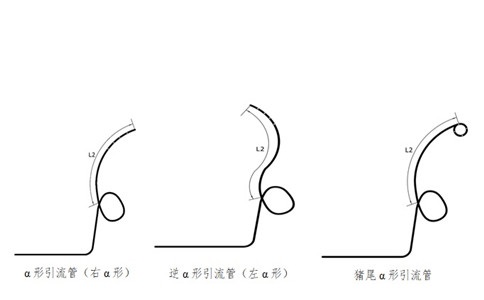
建議應給出引流管及組件的示意圖。
3.1.2.1引流管的外徑、內徑、總長度、遠端長度(L2)、固定圈形狀要求。
3.1.2.2經鼻管的外徑和長度。
3.2物理性能
3.2.1射線可探測性(如適用)
如果生產商標示射線可探測,應能提供相應的試驗證據。
3.2.2抗彎曲性
引流管的管體在彎曲狀態下是否可靠支撐引流的完成(待相關行業標準發布后參照執行)。
3.2.3抗變形(適用于連接負壓泵的產品)
預期在負壓使用下的任何組件,在生產商標稱的最大負壓下應無明顯影響其功能的變形。
3.2.4無泄漏
引流管或任何組件在生產商標稱的最大負壓下應無泄漏。
3.2.5斷裂力
3.2.5.1連接器
連接器的定義參照GB/T 15812.1《非血管內導管第1部分:一般性能試驗方法》附錄F的規定:即按照制造商的說明,需要裝配的連接器。
連接器的最小斷裂力不小于制造商的聲稱值,建議不低于YY 0489《一次性使用無菌引流導管及輔助器械》的相關規定,否則應提交充分的驗證資料證明產品的安全有效性。
3.2.5.2引流導管和其他組件部分
引流導管和其他組件部分的定義參照GB/T 15812.1《非血管內導管第1部分:一般性能試驗方法》附錄B的規定:即產品中各管狀部分、各座或連接器與管路的各連接處、以及不同管路的各連接處。
引流導管和其他組件部分的最小斷裂力不小于制造商的聲稱值,建議不低于YY 0489《一次性使用無菌引流導管及輔助器械》的相關規定,否則應提交充分的驗證資料證明產品的安全有效性。
3.2.6流量
按照GB/T 15812.1《非血管內導管第1部分:一般性能試驗方法》附錄E進行試驗,流量應不小于制造商的聲稱值。
3.2.7魯爾接頭(若適用)
應符合GB/T 1962.1《注射器、注射針及其他醫療器械6%(魯爾)圓錐接頭 第1部分:通用要求》、GB/T 1962.2《注射器、注射針及其他醫療器械6%(魯爾)圓錐接頭 第2部分:鎖定接頭》的要求。
3.2.8配合性能(若適用)
引流管與鼻轉換管的配合性能應予以要求。
3.2.9導絲通暢性
從外引流管遠端插入導絲(導絲直徑由企業制訂),導絲在引流管內應穿行順滑,無明顯阻滯現象。
3.3化學指標
3.3.1環氧乙烷殘留量
3.3.2根據不同材料特性,參照GB/T 14233.1《醫用輸液、輸血、注射器具檢驗方法第1部分:化學分析方法》,由企業決定對化學性能提出要求項目,至少應包括還原物質、酸堿度、重金屬總含量、蒸發殘渣。
3.4無菌性能:以滅菌包裝提供的產品應無菌。
