醫療器械臨床試驗、體外診斷試劑臨床試驗法規及監管制度來源于藥品臨床試驗法規,但是由于產品的特性及風險差異較大,醫療器械臨床試驗法規與藥品、體外診斷試劑臨床試驗法規又存在較大差異,我們一起來看一下。
引言:醫療器械臨床試驗、體外診斷試劑臨床試驗法規及監管制度來源于藥品臨床試驗法規,但是由于產品的特性及風險差異較大,醫療器械臨床試驗法規與藥品、體外診斷試劑臨床試驗法規又存在較大差異,我們一起來看一下。
一、藥品、體外診斷試劑、醫療器械臨床試驗法規見下圖:
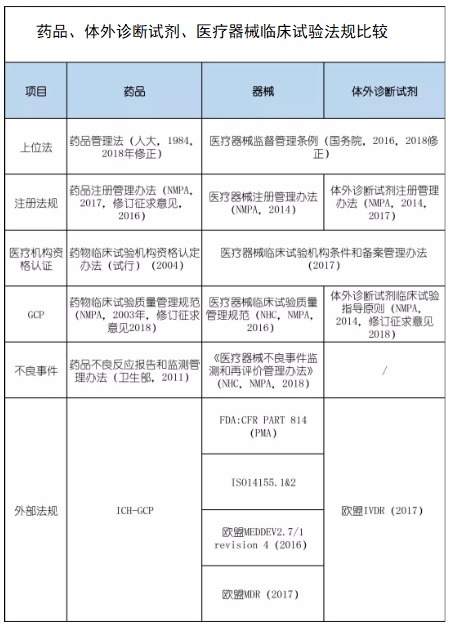
二、醫療器械臨床試驗法規與藥品、體外診斷試劑法規的差異說明:
1、首先,我們看到,醫療器械臨床試驗法規與體外診斷試劑在國內基本一致,在國外則存在差異。
2、醫療器械臨床試驗質量管理規范及體外診斷試劑臨床試驗指導原則來源于藥物臨床試驗管理規范,但與其又存在較大差異,特別是在臨床試驗分期方面。
3、不良事件層面,主要是報告對象及事故處理方面存在較大差異。
4、注冊法規層面,藥品與醫療器械、體外診斷試劑存在較大差異,醫療器械與體外診斷試劑基本一致。