在中國, MitraClip System經導管二尖瓣夾及可操控導引導管主要通過提交境外臨床試驗數據進行臨床評價,還補充了來自文獻的中國人群、亞太人群的臨床經驗數據,并于2020年6月15日和2021年4月20日獲批。
在中國, MitraClip System經導管二尖瓣夾及可操控導引導管主要通過提交境外臨床試驗數據進行臨床評價,還補充了來自文獻的中國人群、亞太人群的臨床經驗數據,并于2020年6月15日和2021年4月20日獲批。
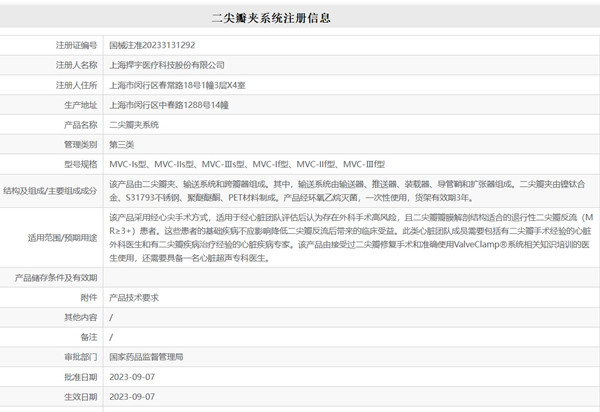
上海捍宇醫療科技股份有限公司的二尖瓣夾系統于2023年8月31日批準上市,該產品通過經心尖介入治療方式將二尖瓣夾輸送至二尖瓣瓣葉處,二尖瓣夾經超聲引導定位并夾持住二尖瓣的前葉和后葉,使瓣葉緊密對接,然后操作輸送系統釋放二尖瓣夾,從而達到降低二尖瓣反流的目的。該產品通過臨床試驗路徑進行臨床評價,采用前瞻性、多中心、單組目標值的試驗設計,以驗證該產品的安全性及有效性。試驗共入組 102 例受試者。有效性評價指標包括術后 360 天時產品有效率(無死亡、無二尖瓣瓣膜再次手術發生率,二尖瓣反流(MR)≤2級),術后即刻、術后 30 天、術后180 天產品有效率(無死亡、無二尖瓣瓣膜再次手術發生率,MR≤2 級)。安全性評價指標包括術后即刻、出院前及 30 天、180 天和 360 天收集并評價以下指標:通過超聲等記錄的夾合部位發生的不良事件、患者 NYHA 心功能分級、實驗室檢查異常及判斷說明等。該臨床試驗于2019年啟動,當時國內尚無同類產品上市,因此無法使用陽性器械進行對照。該產品適用于經心臟團隊評估后認為存在外科手術高風險的患者,因此也無法以外科手術作為對照組。
根據現有經導管二尖瓣夾系統的適用范圍和設計特征,對該類器械的臨床試驗設計提出如下建議:
(一)對于適用于經心臟團隊評估后認為存在外科手術高風險,且二尖瓣瓣膜解剖結構適合的退行性二尖瓣反流(MR≥3+)患者的二尖瓣夾合器系統,如參考《醫療器械臨床試驗設計指導原則》有合理理由可選擇單組設計時,考慮到單組設計實質是將主要評價指標的試驗結果與已有臨床數據進行比較,以評價試驗器械的有效性/安全性,存在非同期對照偏倚,包括選擇偏倚、混雜偏倚、測量偏倚和評價偏倚等,因此申請人在選擇單組設計時應重點關注如下內容:
1.試驗器械的適用人群、主要評價指標(如觀察方法、隨訪時間、判定標準等)需被充分定義且穩定,并采取充分的偏倚控制措施。需設置恰當的入排標準,入選標準需保障受試人群對預期使用人群的代表性,排除標準旨在盡可能規范受試者的同質性。臨床試驗的主要有效性終點建議為術后 12個月產品有效率(無死亡、無二尖瓣瓣膜再次手術發生,二尖瓣反流(MR)≤2級),主要安全性終點建議設為30天內的MAEs發生率。次要評價指標建議考慮:術后6個月和12個月的MAEs發生率、術后30天和6個月的產品有效率、NYHA心功能分級、SF36測量的生活質量、6分鐘步行測試、左心室功能(LVEF左室射血分數、LVEDV左室舒張末容積、LVESV左室收縮末容積、LVIDs左室收縮末內徑、LVIDd左室舒張末內徑)和心衰再住院情況等。
2.目標值的設定需依據充分的循證醫學證據,全面收集具有高質量水平及相當數量病例的臨床研究數據,并進行科學分析(如Meta分析)。由于單組設計可能存在選擇偏倚、混雜偏倚等問題,申請人應詳細比對臨床試驗與用于目標值構建的臨床研究數據的患者基線數據,以及各評價指標定義的一致性(如MAEs和“有效”的定義)。由于單組目標值試驗無法確證試驗器械的優效、等效或非劣效,僅能確證試驗器械的有效性/安全性達到專業領域內公認的最低標準,因此,確定的目標值需科學、客觀,包括靶值和單側置信區間界限,確保臨床試驗可基于充分的樣本量得出產品安全、有效的結論。
(二)對于適用于使用最大劑量的指南導向藥物治療后仍有癥狀的中重度或重度繼發性二尖瓣反流患者的二尖瓣夾合器系統,申請人需開展隨機對照試驗,可選取僅接受指南導向藥物治療(GDMT)或陽性器械作為對照組。
如有醫療器械臨床試驗服務需求,歡迎您隨時方便與杭州證標客醫藥技術咨詢有限公司聯絡,聯系人:葉工,電話:18058734169,微信同。