經導管二尖瓣夾產品在我國屬于第三類醫療器械注冊產品,在國家藥監局公布的創新醫療器械時,有數個相關產品進入創新醫療器械審批通道。考慮到產品的創新新,多數醫療器械注冊人都是摸石頭過河,因此,本文為大家介紹FDA已上市經導管二尖瓣夾系統臨床評價情況。
經導管二尖瓣夾產品在我國屬于第三類醫療器械注冊產品,在國家藥監局公布的創新醫療器械時,有數個相關產品進入創新醫療器械審批通道。考慮到產品的創新新,多數醫療器械注冊人都是摸石頭過河,因此,本文為大家介紹FDA已上市經導管二尖瓣夾系統臨床評價情況。
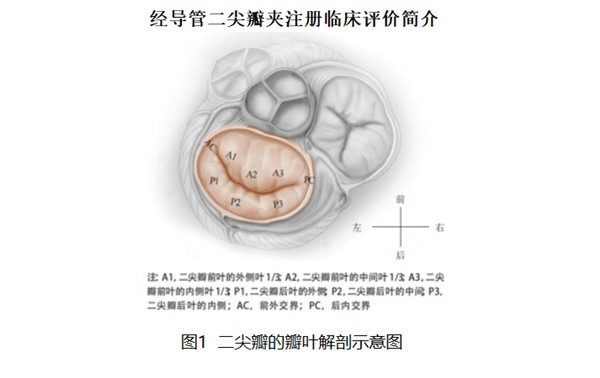
經導管二尖瓣夾及可操控導引導管MitraClip System
MitraClip System是首個在FDA獲批的二尖瓣夾合器系統,在開展了EVEREST I Feasibility可行性研究后,2005年開始了EVEREST II RCT(以下簡稱RCT)研究。該臨床研究的對照組為外科手術,受試者為預期接受二尖瓣外科手術的人群。試驗過程中,部分重度二尖瓣反流患者經醫生判斷由于外科手術風險過高而無法入組RCT研究,因此2007年該項目補充開展了EVEREST II HRR(以下簡稱HRR)單臂臨床研究,并入組二尖瓣外科手術高風險人群,RCT和HRR同步篩選受試者。RCT和HRR完成入組后, Continued Access Registry REALISM于2009年啟動,該研究包含兩個隊列:外科手術高風險隊列(以下簡稱HR)和非外科手術高風險隊列,該研究可供醫生和患者在MitraClip System注冊申報期間繼續使用該產品的同時,申辦方也可繼續收集安全性和有效性數據。
根據FDA公開的審評信息,盡管RCT研究證實MitraClip System可以被安全植入并降低大部分患者的二尖瓣反流,但有效性不及外科手術(具體臨床試驗結果見表1),因此該臨床研究不足以支持MitraClip System在手術候選人群中使用。
圖1 EVEREST II RCT臨床試驗結果總結
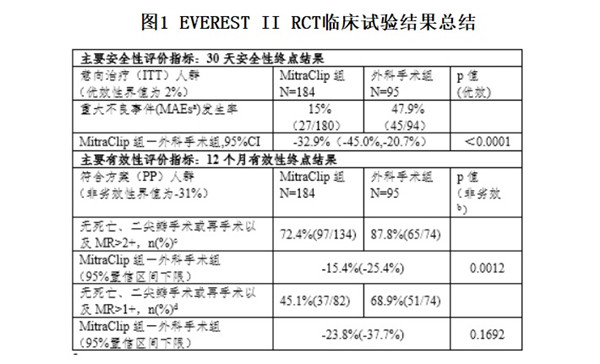
a. MAEs是包括死亡、心肌梗死(MI)、修復或置換手術失敗而導致的再手術、不良事件導致的非計劃心血管手術、中風、腎功能衰竭、深部創口感染、連續48小時通氣、胃腸道(GI)并發癥導致的手術、新發的持續性房顫、敗血癥以及輸注2個及以上單位的血液等臨床事件的復合指標。
b. 此處p值是基于非劣效界值為-31%計算出來的,然而由于非劣效界值過大,該結果不意味著存在非劣效性結論。
c. 申辦方雅培預設的終點
d. FDA預設的終點
申請人通過與FDA和臨床專家探討,MitraClip System在2011年4月縮窄了申報范圍,只針對因外科手術風險過高而無法接受治療的退行性二尖瓣反流(Degenerative Mitral Regurgitation,DMR)和功能性二尖瓣反流(Functional Mitral Regurgitation,FMR)患者。HRR和REALISM HR(REALISM非外科手術高風險隊列于2011年9月暫停入組)兩個單臂臨床研究針對這部分人群開展,但是存在局限性,包括:二尖瓣反流病因的異質性、數據合并、事后設置對照組(杜克大學醫學中心數據庫中65例外科手術高風險DMR患者)、事后分析、數據可靠性以及難以定義受試者的手術風險。
在2013年3月20日的專家咨詢會上,與會專家認為EVEREST II HRR和REALISM HR研究中351名患者的臨床數據合理地證明了MitraClip System在外科手術高風險人群中的使用是安全的。然而,由于上述的局限性,尤其是受試者手術風險定義和二尖瓣反流病因的異質性,大部分專家咨詢小組成員無法得出有效性的結論。會后,FDA與申請人共同決定使用HRR和REALISM HR入組的外科手術高風險DMR患者來評價MitraClip System的風險受益,因為經導管二尖瓣緣對緣修復術對DMR患者減少二尖瓣反流的價值更為明確。DMR是一種瓣膜出現的“機械故障”,目前尚無有效藥物手段來降低DMR導致的二尖瓣反流,只能用“機械”的方法來矯正。但對于FMR來說,最佳藥物治療有一定受益,因為FMR繼發于左心室功能障礙,而左心室功能障礙可以通過藥物治療、血運重建和/或心臟再同步治療得到改善。因此,MitraClip System在FMR中的臨床受益無法通過現有的單臂研究結果來確定。
最終,通過對EVEREST II、HRR和REALISM中127例外科手術高風險DMR患者的臨床數據進行分析,FDA批準了MitraClip System用于二尖瓣原發性異常(退行性二尖瓣反流)導致的顯著癥狀性二尖瓣反流(MR≥3+)病例,經心臟團隊確診,存在二尖瓣手術高風險的患者。
針對FMR,MitraClip System在2012年12月開展了COAPT研究,在美國和加拿大的78個中心招募了614名患有中重度或重度二尖瓣反流,并且在最大藥物治療劑量下仍有癥狀的心力衰竭患者。受試者被隨機分至接受經導管緣對緣修復術聯合指南導向藥物治療組(MitraClip System + GDMT)或僅接受指南導向藥物治療(GDMT)組。試驗的主要有效性終點是兩年內的心衰住院率,主要安全性終點是12個月內無器械相關安全性事件發生的概率。基于COAPT研究,FDA批準了MitraClip System用于使用最大劑量的指南導向藥物治療后仍有癥狀的中重度或重度繼發性二尖瓣反流患者。
如有第三類醫療器械注冊咨詢服務需求,歡迎您隨時方便與杭州證標客醫藥技術咨詢有限公司聯絡,聯系人:葉工,電話:18058734169,微信同。