對于在醫療器械注冊進程中,臨床試驗前,醫療器械產品是否需要做動物實驗對很多行業從業者都是一個問題,今年初,國家藥品監督管理局組織制定了《醫療器械動物實驗研究技術審查指導原則 第一部分:決策原則》,為企業提供了是否需要做動物實驗決策的法規依據。
引言:對于在醫療器械注冊進程中,臨床試驗前,醫療器械產品是否需要做動物實驗對很多行業從業者都是一個問題,今年初,國家藥品監督管理局組織制定了《醫療器械動物實驗研究技術審查指導原則 第一部分:決策原則》,為企業提供了是否需要做動物實驗決策的法規依據。
一、醫療器械注冊是否需要做動物實驗的法規依據:
2019年4月18日,國家藥監局為加強醫療器械產品注冊工作的監督和指導,進一步提高注冊審查質量,國家藥品監督管理局組織制定了《醫療器械動物實驗研究技術審查指導原則 第一部分:決策原則》,為企業和審評人員、監管人員判定醫療器械注冊過程中是否需要做動物實驗提供了法規依據。
二、醫療器械注冊過程中可能需要做動物實驗的產品舉例:
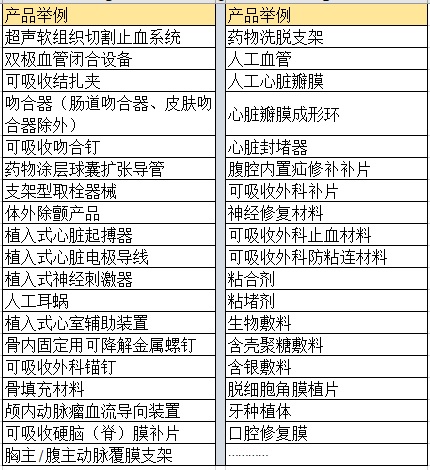
杭州證標客醫藥技術咨詢有限公司位于中國杭州,是醫療器械專業服務第三方。為廣大客戶提供醫療器械法律法規、經營開辦、醫療器械生產質量管理體系、醫療器械注冊、臨床、CRC、CE、FDA、醫療信息系統定制開發一站式服務,是江浙滬地區極少數有醫療器械全流程服務能力的機構之一。任何有關醫療器械注冊、醫療器械經營許可/備案、醫療器械臨床試驗、CRC服務事宜,隨時方便聯系葉工(MP:18058734169,微信同)。