醫療器械臨床試驗稽查分為項目稽查、系統稽查、供應商稽查(比如:CRO公司選擇、中心實驗室選擇等),一般情況下針對臨床試驗機構的項目稽查居多。政策和執法尺度不斷在變化,項目稽查可以從臨床試驗中機構選擇、臨床試驗操作到臨床試驗結束貫穿整個臨床試驗的全部過程,依照現行法規對臨床試驗項目進行全方位的稽查。
醫療器械臨床試驗稽查分為項目稽查、系統稽查、供應商稽查(比如:CRO公司選擇、中心實驗室選擇等),一般情況下針對臨床試驗機構的項目稽查居多。政策和執法尺度不斷在變化,項目稽查可以從臨床試驗中機構選擇、臨床試驗操作到臨床試驗結束貫穿整個臨床試驗的全部過程,依照現行法規對臨床試驗項目進行全方位的稽查。
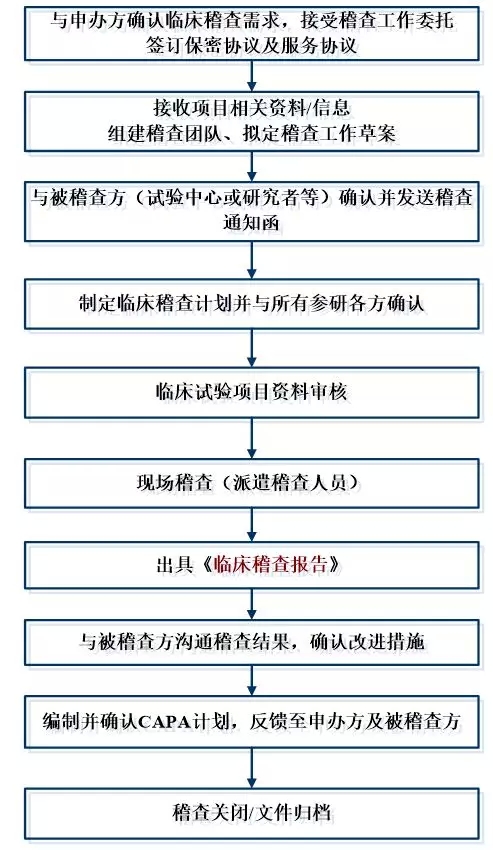
醫療器械臨床試驗稽查一般流程如下:
1、企業委托第三方稽查公司,簽訂稽查協議。
2、第三方稽查公司接收臨床試驗項目相關資料,包括但不限于臨床試驗方案、ICF、CRF、原始記錄等相關文件。
3、企業和第三方稽查公司共同確定被稽查的臨床試驗機構和稽查時間。
4、第三方稽查公司組建稽查團隊,制訂稽查方案、稽查記錄表格等。
5、企業向被稽查的機構提出稽查申請,發出稽查函,獲得機構批準。
6、第三方稽查公司在臨床試驗機構召開稽查啟動會,向臨床試驗機構的有關人員介紹本次稽查的目的、內容和程序,并請主要研究者介紹臨床試驗的有關情況。
7、請求研究者的協助,請其向相關輔助科室發出稽查通知,獲得輔助科室的配合。
8、派遣稽查人員進駐臨床試驗機構進行現場稽查,對研究者文件夾、知情同意書、原始文件/病例報告表、機構HIS、LIS系統等進行稽查。
9、根據發現的問題提出建議并分別與研究者、機構老師確認并溝通解決辦法。
10、整理稽查記錄及問題,完成稽查報告。
11、與申辦方溝通,完成整改報告。
醫療器械臨床試驗稽查流程圖: