在醫療機構中使用,通過對人體組織的汽化、碳化、凝固和照射達到治療的目的的,用于(具體部位)的手術/預期用于(具體皮膚病癥)治療的二氧化碳激光治療設備在我國屬于第三類醫療器械注冊?產品。近日,國家藥監局發布《二氧化碳激光治療設備注冊審查指導原則(征求意見稿)》,借這個契機,寫個文章為大家說說二氧化碳激光治療設備注冊要點及產品技術要求。
在醫療機構中使用,通過對人體組織的汽化、碳化、凝固和照射達到治療的目的的,用于(具體部位)的手術/預期用于(具體皮膚病癥)治療的二氧化碳激光治療設備在我國屬于第三類醫療器械注冊產品。近日,國家藥監局發布《二氧化碳激光治療設備注冊審查指導原則(征求意見稿)》,借這個契機,寫個文章為大家說說二氧化碳激光治療設備注冊要點及產品技術要求。
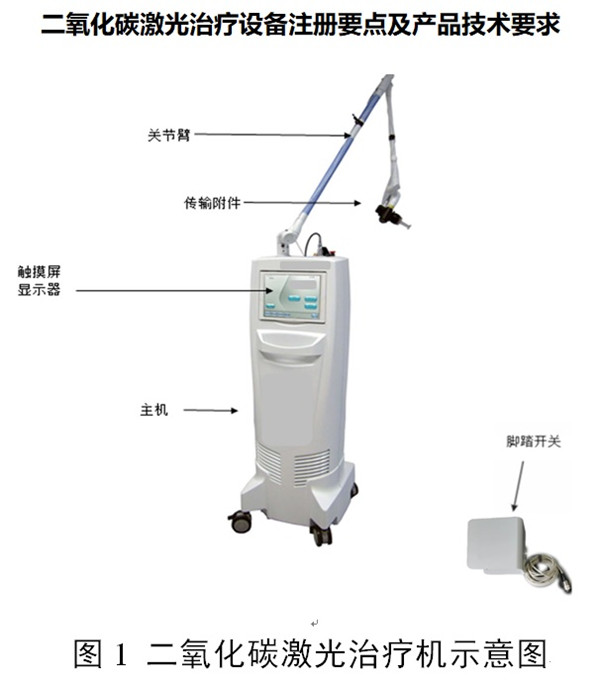
一、二氧化碳激光治療設備注冊產品的工作原理及作用原理
二氧化碳激光治療設備通常由二氧化碳激光器、電源和控制系統、安全防護系統、瞄準傳輸系統、冷卻系統和輸出系統及附件(可包括輸出手具、掃描裝置/點陣輸出裝置、腳踏開關、護目鏡等)組成。按照現行《醫療器械分類目錄》,此類產品分類編碼為:01-02-01或09-03-01,管理類別為Ⅲ類。按照臨床用途,用于手術室外科手術的二氧化碳激光手術設備分類為:01-02-01,用于皮膚科、整形科的二氧化碳激光治療設備分類為:09-03-01。二氧化碳激光治療設備通常屬于強激光。
1.1工作原理
二氧化碳(CO2)激光器是以CO2氣體分子作為工作物質的氣體激光器。可輸出激光波長為10.6μm或9.6μm,常見波長為10.6μm。二氧化碳激光器的工作物質除了CO2氣體外,還有適量的輔助氣體氮氣(N2)和氦氣(He)等。
二氧化碳分子經電壓激發后從低能級躍遷到高能級上形成粒子束反轉發出激光能量,二氧化碳激光的能級躍遷可分別發射10.6μm或9.6μm的激光,10.6μm和9.6μm兩條譜線有共同的激光上能級,因此它們之間產生強烈的譜線競爭,由于10.6μm波長的躍遷幾率比9.6μm的大,所以通常CO2激光器的輸出激光波長為10.6μm。
典型的封離式CO2激光器結構包括腔片、放電管、電極和電源等幾部分。二氧化碳激光管通常由硬質玻璃制成,采用套筒式結構,最里面一層是放電管,第二層為水冷套管,最外層為儲氣管。諧振腔通常由全反射鏡和部分反射鏡組成,主要作用是控制光束的傳播方向,提高單色性,選定輸出模式和增長激活介質的工作長度。泵浦源提供能量使工作物質中上下能級間的粒子數反轉。
申報產品的綜述資料中應說明CO2激光器的類型,特別是如果采用非典型的封離式激光器,應明確其具體類型及設計依據。
1.1.2作用原理
激光與人體組織的相互作用機理通常可分為熱效應、光化效應、光致爆破效應和生物刺激效應。二氧化碳激光治療設備主要是激光對組織的熱效應。熱效應是指CO2激光的能量能有效地被組織中的水分吸收,組織吸收激光能量后轉化為熱能,導致組織溫度升高。根據組織的不同反應,通常可以實現對人體組織的汽化、碳化、凝固以達到治療的目的。
申報資料的綜述資料中,應說明申報產品的具體作用機理,預期作用的靶組織類型和預期的作用效果。
二、二氧化碳激光治療設備產品技術要求及主要性能指標
醫療器械注冊申請人應按照《醫療器械產品技術要求編寫指導原則》編寫產品技術要求。建議注冊申請人參考對應的國家標準GB/T 11748,并根據自身產品的技術特點制定產品技術要求中的性能指標和測試方法。
產品技術要求應明確產品型號規格及劃分說明。需注明軟件發布版本、軟件版本號命名規則,其中軟件版本命名規則需與軟件研究資料保持一致。
對于性能指標的制定,根據產品自身性能,應至少包括激光波長、激光模式、激光輸出方式及其時間特性、激光脈沖(串)終端輸出能量/功率、激光終端輸出功率/能量的不穩定度、激光終端輸出功率/能量的復現性、激光光斑尺寸、瞄準光波長和功率、冷卻方式(設備冷卻和或接觸部分冷卻)、激光防護鏡防護參數、光纖參數(如適用)、點陣輸出參數(如有)、點陣圖形等。
應注意,若以重復脈沖串的方式輸出,除了子脈沖寬度和間隔,還應有脈沖串寬度和脈沖串間隔要求。二氧化碳激光治療設備如果采用調制技術獲得窄脈沖高峰值功率的激光,應說明調制方式,給出實際的波形圖示及峰值功率。
需生產企業滅菌提供的附件應確保無菌(可參考GB/T 14233.2《醫用輸液、輸血、注射器具檢驗方法 第2部分:生物學試驗方法》的試驗方法)。對于采用環氧乙烷滅菌的產品,應制定環氧乙烷殘留量要求(可參考GB/T 16886.7《醫療器械生物學評價 第7部分:環氧乙烷滅菌殘留量》)。
如產品組成中有腳踏開關,應符合YY/T 1057的要求。
如果組成中包含醫用激光光纖,相關要求應參照《醫用激光光纖注冊技術審查指導原則》,并應符合YY/T 0758的要求。
如涉及網絡安全,應按照《醫療器械網絡安全注冊審查指導原則》,給出產品技術要求中應包含的性能要求和需載明的信息。
對于試驗方法,產品性能指標的試驗方法如依照國標/行標制定,應與國標/行標一致,如申請人自定或者采用國標方法但不完全一致,應在研究資料中的性能研究部分說明自定義指標和方法的科學、合理性依據。另外,所有配用附件(包括聚焦手具、點陣/掃描手具、顯微鏡組件、套筒等)都應分別安裝到設備上進行測試。如選擇典型性型號測試,應有覆蓋性依據。
產品技術要求附錄中應有電氣安全特征和產品外觀(結構)圖示。
三、二氧化碳激光治療設備注冊注意事項
醫療器械注冊人需要特別關注的情況包括:
(1)按照臨床功能(對應手具)分別制定技術指標
二氧化碳激光治療設備具有多個臨床應用模式的情況下,通常在主機顯示界面會對應不同的用戶操作界面,同時在配用相應的手具時,軟件激活對應的操作界面,完成相應的臨床用途。在制定產品技術要求的性能指標時,應按照每種用戶可操作界面,在配用對應的手具下,給出對應的各項激光輸出具體參數。
(2)關于不同技術參數指標之間的關系
當脈沖輸出時,脈沖能量/功率、平均功率、脈寬和頻率等參數需明確開放給用戶調節的是哪個或者哪些參數,其他隨之調節的參數,與可調節參數之間的換算關系需要說明。在產品技術要求中,上述涉及的主要參數均需列入指標要求,具體試驗方法可參照標準規定方法開展。
具體可調節哪些參數,或者在用戶界面顯示哪些參數,由制造商規定。
如有二氧化碳激光治療設備注冊咨詢、第三類醫療器械注冊咨詢、醫療器械產品技術要求編制服務需求,歡迎您隨時方便與杭州證標客醫藥技術咨詢有限公司聯絡,聯系人:葉工,電話:18058734169,微信同。