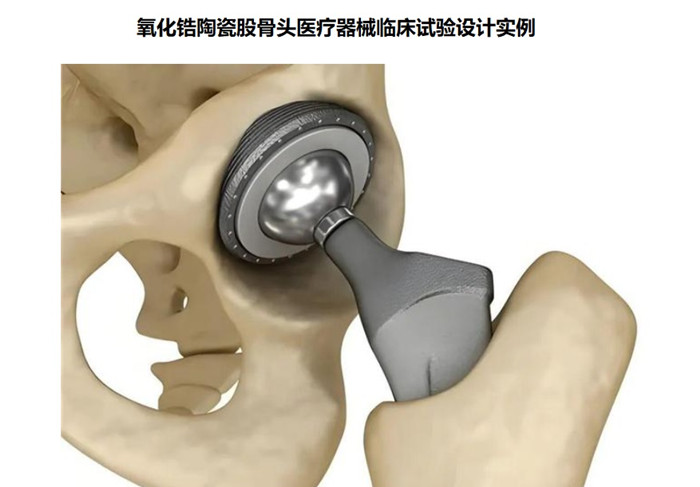
氧化鋯陶瓷股骨頭為髖關節假體組件,股骨柄部插入股骨髓腔內后, 陶瓷股骨頭與髖臼內襯、髖臼(外)杯形成旋轉關節面, 實現髖關節的運動。利用機械原理形成新的關節活動。氧化鋯陶瓷股骨頭在我國屬于第三類醫療器械注冊產品,目前,需要通過醫療器械臨床試驗完成臨床評價,本文為大家介紹氧化鋯陶瓷股骨頭醫療器械臨床試驗設計實例,一起看正文。
氧化鋯陶瓷股骨頭為髖關節假體組件,股骨柄部插入股骨髓腔內后,
陶瓷股骨頭與髖臼內襯、髖臼(外)杯形成旋轉關節面,
實現髖關節的運動。利用機械原理形成新的關節活動。氧化鋯陶瓷股骨頭在我國屬于第三類醫療器械注冊產品,目前,需要通過醫療器械臨床試驗完成臨床評價,本文為大家介紹氧化鋯陶瓷股骨頭醫療器械臨床試驗設計實例,一起看正文。
一、氧化鋯陶瓷股骨頭醫療器械臨床試驗設計要點
申請人選擇臨床試驗路徑進行臨床評價,臨床試驗的目的為評價確認氧化鋯陶瓷股骨頭在預期用途下的安全有
效性。臨床試驗的設計為采用前瞻性、多中心、隨機平行對
照的試驗設計,選擇的對照器械為陶瓷股骨頭 BIOLOX DELTA
Ceramic Femoral Head(國械注進 20183132567),重要的入選標準為患者年齡 18-80 歲(含),性別不限,低于
50 歲的患者應有手術的緊迫性訴求;患者骨骼已成熟;患者具有髖關節置換手術適應癥;參與試驗的一側患肢為初次接受髖關節置換;受試者或其監護人愿意并且能夠簽署
知情同意書。重要的排除標準為有髖關節置換術手術禁忌癥;已知患者對一種或多種植入材料有過敏史;肥胖BMI>35;孕婦或哺乳期婦女;髖關節發育不良CROWE分級
3、4 級;體質虛弱或因全身其他疾病不能耐受手術者,及預期壽命不足 2 年者;其他研究者認為患者不適合本試
驗的原因。
二、氧化鋯陶瓷股骨頭醫療器械臨床試驗需要多少受試者,需要在幾家醫院開展?
臨床試驗在4 家臨床機構(南京大學醫學院附屬鼓樓醫
院、吉林大學中日聯誼醫院、中國人民解放軍陸軍軍醫大
學第二附屬醫院、河南省洛陽正骨醫院(河南省骨科醫
院))開展,計劃入組 144 例,實際入組 144 例受試者,其
中,FAS 集試驗組 71 例,對照組 71 例; PPS 集試驗組 63 例,對
照組 69 例; SS 集試驗組 71 例,對照組 71 例。
三、氧化鋯陶瓷股骨頭醫療器械臨床試驗的主要評價指標是什么?
臨床試驗的主要評價指標:術后 12 個月的 Harris 評分
優良率作為主要評價指標。 Harris 評分的內容包括疼痛、
功能、畸形和關節活動度四個方面,側重于患者疼痛及關
節功能方面評價的同時,加入了關節活動度方面的權重。
四、氧化鋯陶瓷股骨頭醫療器械臨床試驗的次要評價指標是什么?
次要評價指標:包括療效指標和安全性指標。采集術
后、6 周、3 個月、6 個月的 Harris 評分,觀察各個隨訪點
兩組間的療效評分差異。同時能夠構建受試者術后的完整
康復曲線。
五、氧化鋯陶瓷股骨頭醫療器械臨床試驗的安全性指標是什么?
安全性指標方面選取影像學數據、實驗室檢查及不良
事件發生率、假體生存率等客觀指標,評價本產品在臨床
試驗中的安全性。
六、氧化鋯陶瓷股骨頭醫療器械臨床試驗真實試驗結果
臨床試驗結果:主要有效性評價指標 FAS 分析集中,試
驗組術后 12 個月 Harris 評分優良率為 97.18%,對照組術后
12 個月 Harris 評分優良率為 98.59%,組間比較術后 12 個月
Harris 評分優良率無統計學差異(P=0.564),兩組率差 95%
置信區間為(-8.67%, 5.16%)。PPS 分析集中,試驗組術后 12個月Harris評分優良率為98.41%,對照組術后12個月Harris
評分優良率為 98.55%,組間比較術后 12 個月 Harris 評分優
良率無統計學差異(P=0.966),兩組率差 95%置信區間為(-
7.49%, 6.44%)。FAS 和 PPS 集,優效性/非劣效假設成立。次要
療效指標方面,試驗組和對照組在術后±7 天、術后 6 周±
7 天、術后 3 個月±15 天、術后 6 個月±30 天、術后 12 個
月±30 天等各次訪視的 Harris 優良率均無顯著性差異。
安全性評價:對照組嚴重不良事件為 1 例;1 例患者系
間質性肺炎伴感染及Ⅰ型呼吸衰竭死亡;1 例患者因死亡退
出試驗,系因食道癌去世。臨床試驗未發生與申報產品相關的不良事件。此外,補充臨床試驗報告中顯示,在平均隨訪時間為 46.73±3.60 個月,中位隨訪時間 47 個月時,兩
組均未發現有因申報產品質量問題導致的嚴重不良事件,
無假體破碎。