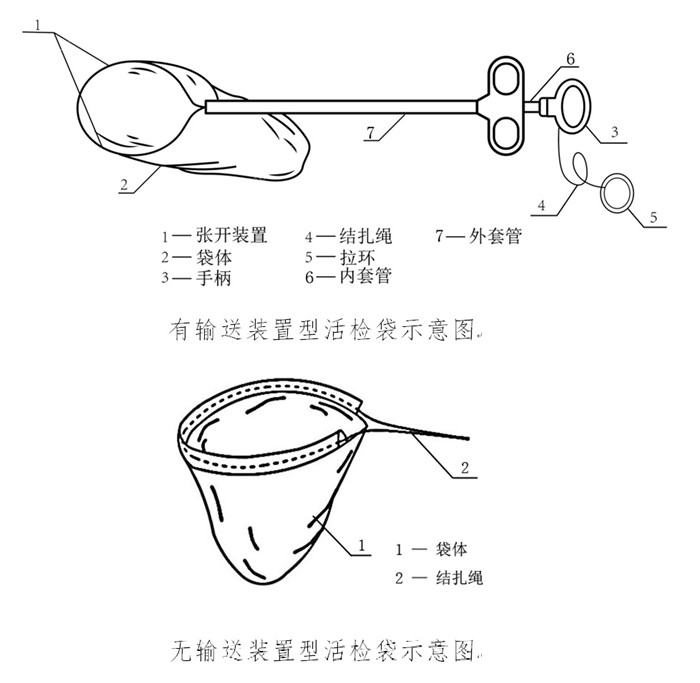
用于腔鏡手術時將活檢樣本從手術區域取出的一次性使用內窺鏡用活檢袋,在我國屬于第二類醫療器械注冊產品。活檢袋通常分為有輸送裝置型和無輸送裝置型兩種,產品通常由活檢袋套管、納物袋、結扎繩、撐開鉗構成。近日,國家藥監局發布《一次性使用內窺鏡用活檢袋注冊審查指導原則(征求意見稿)》,正好借這個機會,為大家介紹一次性使用內窺鏡用活檢袋注冊及醫療器械生產許可證辦理要點,一起看正文。
用于腔鏡手術時將活檢樣本從手術區域取出的一次性使用內窺鏡用活檢袋,在我國屬于第二類醫療器械注冊產品。活檢袋通常分為有輸送裝置型和無輸送裝置型兩種,產品通常由活檢袋套管、納物袋、結扎繩、撐開鉗構成。近日,國家藥監局發布《一次性使用內窺鏡用活檢袋注冊審查指導原則(征求意見稿)》,正好借這個機會,為大家介紹一次性使用內窺鏡用活檢袋注冊及醫療器械生產許可證辦理要點,一起看正文。
一、一次性使用內窺鏡用活檢袋注冊審查要點
注冊申報資料應符合國家藥品監督管理局《關于公布醫療器械注冊申報資料要求和批準證明文件格式的公告》中對注冊申報資料的要求,同時宜符合以下要求:
(一)建議
1.臨床導向
活檢袋設計開發應以臨床為導向,應能保證產品用于臨床的安全和有效。產品設計開發時應充分調研臨床需求并將其準確轉化為設計開發輸入的明確要求,使得最終輸出的產品能保證用于臨床的安全和有效。活檢袋產品的臨床需求通常包括但不限于以下內容:
活檢袋與配套器械(如腹部穿刺器等)的配合活檢袋袋口的撐開
活檢袋袋體的容積
活檢袋袋體的牢固和抗穿刺
活檢袋袋體的密封
獲取標本/異物后活檢袋的回撤
2.有害物質的控制
活檢袋設計開發和生產過程應保證產生的析出物(包括可瀝濾物和/或蒸發物)、加工殘留物等降低到可接受水平,為患者提供最大程度的安全保障。
選擇活檢袋袋體材料時除考慮袋體的物理性能(袋體強度和抗穿刺性等)和與加工方式的相容性外還應充分考慮其析出物(如殘留單體等)對于人體的影響并進行評價。
應結合活檢袋加工助劑的使用情況及采取的去除措施等對加工殘留物的水平進行充分的研究和評價。對于采用環氧乙烷滅菌的活檢袋產品,環氧乙烷及二氯乙醇是其常見的加工殘留物,考慮到活檢袋產品通常折疊為多層結構后再進行滅菌,對于環氧乙烷的擴散和解析會帶來額外的挑戰,在環氧乙烷滅菌及解析過程的設計開發中均應予以充分的考慮和驗證,確保所采用方法對殘留物具有足夠的去除能力,保證其降低到可接受水平。
3.可用性
活檢袋的設計開發應考慮醫療器械可用性工程的要求。
醫療器械可用性工程是醫療器械設計開發的重要組成部分,注冊申請人需在質量管理體系設計開發過程的框架下,參考《醫療器械可用性工程注冊審查指導原則》相應內容及可用性相關標準,建立充分、適宜、有效的可用性工程過程。活檢袋產品可識別為中、低使用風險醫療器械,應基于風險管理過程開展可用性工程全生命周期質控工作,開展使用錯誤評估并形成報告,使用錯誤評估報告用于細化風險管理報告關于可用性的內容,包括基本信息、使用風險級別、核心要素、同類醫療器械上市后使用問題分析、使用風險管理、結論等內容。
二、一次性使用內窺鏡用活檢袋產品技術要求
一次性使用內窺鏡用活檢袋產品性能指標通常包括但不限于以下項目:外觀、尺寸(插入部分的最大寬度、工作長度、袋口尺寸)、操作性能、各使用部位的連接強度(如拉繩與袋體、拉繩與拉環等)、拉繩的強度、袋體接合處的連接強度、袋體密封性能、袋體容積、耐腐蝕性(如適用)、化學性能(澄清度和色澤、酸堿度、重金屬、還原物質、蒸發殘渣等)、環氧乙烷殘留量(如適用)、無菌。
三、一次性使用內窺鏡用活檢袋產品的醫療器械生產許可證辦理要點
對于一次性使用內窺鏡用活檢袋產品來說,辦理醫療器械生產許可證的要點一是企業應該具備符合要求的產品生產能力和質量保證能力,這些能力包括人機料化法測這些過程要素及公司綜合管理能力;二是企業應按照GB/T42061-2022/ISO13485:2016《醫療器械 質量管理體系 用于法規的要求》、《醫療器械生產質量管理規范》、《醫療器械注冊質量管理體系核查指導原則》建立公司質量管理體系,并持續合規運行醫療器械質量管理體系。
如有一次性使用內窺鏡用活檢袋注冊或是醫療器械生產許可證辦理服務需求,歡迎您隨時方便與杭州證標客醫藥技術咨詢有限公司聯絡,聯系人:葉工,電話:18058734169,微信同。