?在內窺鏡檢查和手術中配合內窺鏡使用的無源內窺鏡用剪,在我國屬于第二類醫療器械注冊產品,依據最新適用的《醫療器械分類目錄》,其分類編碼為02-03-03。近日,國家藥監局發布了《內窺鏡手術用剪注冊審查指導原則(征求意見稿)》,正好帶大家了解內窺鏡手術用剪產品技術要求及注冊審查要點。
在內窺鏡檢查和手術中配合內窺鏡使用的無源內窺鏡用剪,在我國屬于第二類醫療器械注冊產品,依據最新適用的《醫療器械分類目錄》,其分類編碼為02-03-03。近日,國家藥監局發布了《內窺鏡手術用剪注冊審查指導原則(征求意見稿)》,正好帶大家了解內窺鏡手術用剪產品技術要求及注冊審查要點。
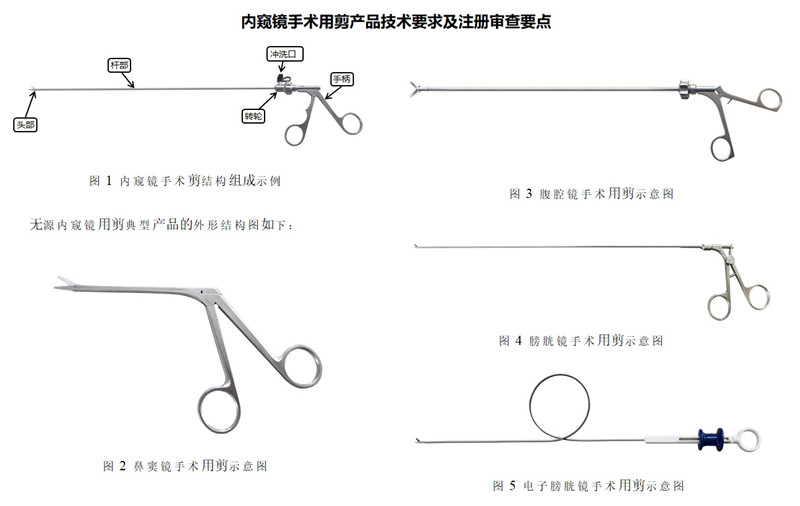
一、內窺鏡手術用剪產品注冊單元的劃分
內窺鏡手術用剪產品注冊單元劃分應符合《醫療器械注冊單元劃分指導原則》的要求,原則上以產品的技術原理、結構組成、性能指標和適用范圍為劃分依據。
產品結構組成、性能指標或加工處理方式不同而導致產品適用范圍不同時,原則上劃分為不同的注冊單元。例如鼻竇鏡手術剪與腹腔鏡手術剪應劃分為不同的注冊單元。
一次性使用內窺鏡用剪與可重復性使用內窺鏡用剪建議劃分為不同注冊單元。
二、內窺鏡手術用剪產品工作原理及產品描述
2.1工作原理
內窺鏡手術用剪刀頭為一對帶刃口的刀片,通過手柄操作傳遞、控制刀頭刀片的運動,供施行內窺鏡手術時剪切使用。
2.2原材料
詳述產品所用原材料(包括交聯劑等任何生產過程中加入的成分及預裝器材等)的中文化學名稱、化學結構式/分子式、材料商品名(若有)、材料代號/牌號(若有)、符合的標準以及與人體的接觸方式。進口產品的材料應與原產國上市證明文件/說明書批準的范圍一致。
若刀頭帶有涂層的,應給出涂層成分、涂層特征及作用、涂層在器械上的位置及涂覆范圍、涂層涂覆方式及工藝。考慮滅菌方式對涂層的影響,如涂層對環氧乙烷解析的影響。若涂層對包裝有特殊要求,建議明確。一般來說,涂層成分宜為有長期醫療器械安全應用史的化學物質。
2.3交付狀態及滅菌方式
以無菌方式提供的內窺鏡手術用剪,應描述滅菌實施者、滅菌方法、滅菌有效期。
以非無菌方式提供的內窺鏡手術用剪,應明確推薦的清洗、消毒工藝(方法和參數)和滅菌工藝(方法和參數)。
2.4結構組成及功能
提供產品結構示意圖和/或產品圖示、使用方法以及區別于其他同類產品的特征等內容。結合實物圖或示意圖,對產品的結構組成進行詳盡描述,可給出橫截面圖(若不同位置橫截面不同,應分別給出)、縱剖面圖;應給出頭端部分放大結構圖,明確不同頭端形狀。體現手柄操作部分、插入部分、頭端部分、轉輪部分、沖洗口部分等的細節,不同型號產品若不能被典型性型號覆蓋,應分別給出結構組成圖示。
該產品通常由頭部、桿部或軟性導管、轉輪(若有)、沖洗口(若有)和手柄組成,頭部為一對帶刃口的刀片,通過手柄操作傳遞、控制頭部工作。一般頭部采用不銹鋼材料制成。

三、內窺鏡手術用剪產品技術要求及性能指標
產品技術要求應至少包括以下內容:
(1)外觀
內窺鏡手術用剪剪刀頭的兩片應相互吻合,不得有錯位現象,刃面不得有卷刃、崩刃現象,其他部位一般應光滑圓潤,表面應無非設計預期的鋒棱、裂紋、毛刺等。
內窺鏡手術用剪頭端部分應經過處理,在內窺鏡視野中可見的頭端部分無定向反射現象。
(2)尺寸
內窺鏡手術用剪應明確產品規格尺寸和公差,應標稱器械的工作長度、張開角度、桿部外徑等,一般采用圖表明示。尺寸允許公差參照可參照行業標準中的相關要求(如YY/T 0672.2)。
(3)硬度
內窺鏡手術用剪硬度如有國家標準、行業標準要求,應執行相應標準;如無相應標準要求,注冊申請人可根據產品實際情況明確硬度要求,但應滿足臨床使用要求。
(4)表面粗糙度
內窺鏡手術用剪的表面粗糙度如有國家標準、行業標準要求,應按國家標準、行業標準執行;如無相應國家標準、行業標準要求,注冊申請人可根據產品實際情況明確表面粗糙度要求,但應滿足臨床使用要求。
(5)剪切性能
剪刀應有良好的剪切性能,切口光滑并能順利剪切規定的試驗材料,剪切后無纖維拉出現象。
(6)開閉靈活性
剪刀開閉應靈活,不應有咬口、卡滯現象。有轉輪功能的,刀頭應360°內轉向自如。
(7)耐腐蝕性能
內窺鏡手術用剪的不銹鋼部位外表面的耐腐蝕性能可參考相關標準(如:YY/T 0149)的相關試驗方法。其他材料用說明書中指定的滅菌方法滅菌后,應無腐蝕現象。
(8)連接牢固度
內窺鏡手術用剪各連接部位應牢固可靠,若有焊接,焊縫應平整光滑,無脫焊或堆焊現象。拆卸、裝配應方便,裝配后連接部位牢固,無松脫現象。
(9)沖洗接頭(如適用)
如沖洗接頭采用魯爾接頭,可參考相關標準(如:GB/T 1962.2-2001《注射器、注射針及其他醫療器械6%(魯爾)圓錐接頭 第2部分:鎖定接頭》)的相關試驗方法。
(10)通水性能(如適用)
應具有良好的通水性能。
(11)化學性能(如適用)
根據不同材料的特性,申請人應對產品與人體接觸部分的高分子材料的化學性能制定相應要求,如酸堿度、重金屬總含量、還原物質等。
(12)無菌(如適用)
無菌內窺鏡手術用剪經確認的方法滅菌后應無菌。若產品滅菌后可能產生殘留,則殘留量應符合相關標準要求。
(13)其他
企業對宣稱的所有其他技術參數和功能,均應在產品技術要求中予以規定。
如有內窺鏡手術用剪產品技術要求或是醫療器械注冊咨詢服務需求,歡迎您隨時方便與杭州證標客醫藥技術咨詢有限公司聯絡,聯系人:葉工,電話:18058734169,微信同。