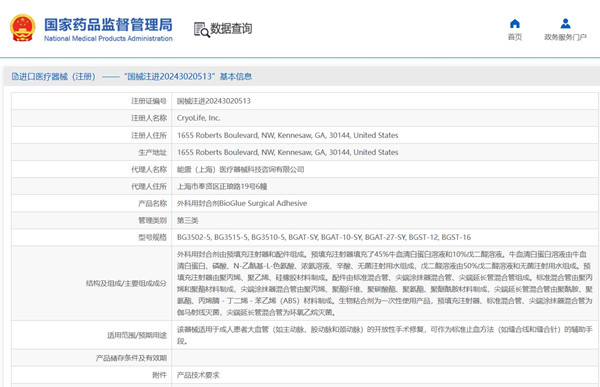
適用于成人患者大血管(如主動脈、股動脈和頸動 脈)的開放性手術修復,可作為標準止血方法(如縫合線和縫合針)的輔助手段的外科用封合劑���,在我國屬于第三類醫療器械注冊產品����。該產品由預填充注射器和配件組成�����。預填充注射器填充了 45%牛血清白蛋白溶液和10%戊二醛溶液�����。配件由標準混合管、尖端涂抹器混合管、尖端延長管混合管組成���。
引言:適用于成人患者大血管(如主動脈、股動脈和頸動
脈)的開放性手術修復�����,可作為標準止血方法(如縫合線和縫合針)的輔助手段的外科用封合劑,在我國屬于第三類醫療器械注冊產品。該產品由預填充注射器和配件組成���。預填充注射器填充了 45%牛血清白蛋白溶液和10%戊二醛溶液���。配件由標準混合管����、尖端涂抹器混合管、尖端延長管混合管組成。產品為一次性使用����,預填充注射器�����、標準混合管、尖端涂抹器混合管為伽馬射線滅菌,尖端延長管混合管為環氧乙烷滅菌�����。
一���、外科用封合劑注冊產品工作原理
外科用封合劑是一種雙組分的外科粘合劑���,由純化的牛血清白蛋白(BSA)溶液和戊二醛構成����。采用雙腔針管、標準混合管以及可選混合管構成的輸送系統來涂抹溶液���。按預定比例配制的溶液在標準混合管內混合,并發生交聯�����。戊二醛分子與牛血清白蛋白分子形成共價結合(交聯)����,接觸修復部位的組織蛋白質時���,將形成一個柔性的機械密封層���,這種作用不依賴于人體的凝血機制����。輸送系統可使外科用封合劑的組分在體外反復混合。外科用封合劑在20-30秒鐘內開始進行聚合����,在2分鐘內達到其粘合強度���。外科用封合劑也能通過人工血管基質的間隙形成機械式聯鎖�����,粘合到人工血管的基質之上。
二����、外科用封合劑產品技術要求
外科用封合劑產品性能評價初常規性能指標外����,還應包括:戊二醛
中甲醇濃度�����、戊二醛分析集相關雜質分析、BSA與戊二醛交聯過程的吸/放熱性能、聚合后BSA測定�����、微生物指標、聚合后戊二醛殘留等���。
三、外科用封合劑產品注冊要點
1.外科用封合劑注冊產品生物相容性要做哪幾項�����?
外科用封合劑注冊產品為與組織和組織液接觸的持久植入器械�����,依據 GB/T16886系列標準對其進行了生物相容性評價����,進行了細胞毒�����、
致敏反應�����、皮內反應、遺傳毒性�����、血液相容性���、植入�����、亞慢
性毒性、急性全身毒性和熱原測試;對于配件也進行了細胞
毒性試驗����、致敏試驗�����、皮內反應試驗、溶血試驗及急性毒性試驗。
2.外科用封合劑注冊產品滅菌方式選擇
外科用封合劑注冊產品由預填充注射器和配件(包括標準混合管、尖端涂抹器混合管����、尖端延長管混合管)組成����,預填充注射器�����、標準混合管�����、尖端涂抹器混合管為伽馬射線滅菌,尖端延長管混合管為環氧乙烷滅菌。申請人提供了滅菌確認報告���,證明滅菌后的無菌保證水平均可達到10-6。
3.外科用封合劑注冊產品有效期和包裝
申報產品包括預填充注射器和配件(包括標準混合管、
尖端涂抹器混合管、尖端延長管混合管)���,其中�����,預填充注射器 BG3510-5的滅菌有效期為24個月���,預填充注射器
BG3502-5 為 21 個月����,預填充注射器 BG3515-5為18個月。配件的滅菌有效期為60個月�����。申請人提供了加速老化的有效期驗證報告和實時有效期驗證報告����,并按照化學藥品與包裝材料相容性研究指導原則開展了相容性驗證研究。
如有外科用封合劑注冊或其他第三類醫療器械注冊咨詢服務需求,歡迎您隨時方便與杭州證標客醫藥技術咨詢有限公司聯絡���,聯系人:葉工,電話:18058734169,微信同。