近日,浙江省藥監局發布了創新醫療器械注冊產品——液囊腸梗阻導管技術審評報告,我個人特別關注創新醫療器械產品,一方面通過創新醫療器械可以關注產業前沿,另一方面,也可以看醫療器械注冊審評尺度和風向。一起來看看液囊腸梗阻導管注冊流程、要求和相關審評要點。
近日,浙江省藥監局發布了創新醫療器械注冊產品——液囊腸梗阻導管技術審評報告,我個人特別關注創新醫療器械產品,一方面通過創新醫療器械可以關注產業前沿,另一方面,也可以看醫療器械注冊審評尺度和風向。一起來看看液囊腸梗阻導管注冊流程、要求和相關審評要點。
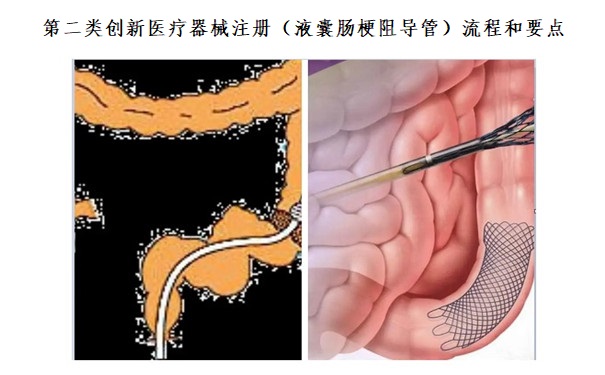
一、第二類創新醫療器械注冊(液囊腸梗阻導管)流程:
創新是開拓,是填補空白,對于醫療器械注冊來說,也意味著需要開展醫療器械臨床試驗。液囊腸梗阻導管注冊流程如下:前期準備——醫療器械質量管理體系建設——產品研發及樣品生產——醫療器械注冊檢驗——醫療器械臨床試驗——醫療器械注冊申報——技術審評——注冊質量管理體系考核——取得醫療器械注冊證——申請醫療器械生產許可證——取得醫療器械注冊證。
二、液囊腸梗阻導管工作原理
液囊腸梗阻導管與相關的負壓器連接,在導管內形成負壓或靠腸道內的壓力,將潴留在胃腸內的內容物吸出。液囊腸梗阻導管經鼻食道插入胃部后,經液囊接頭注入適量的液體,導管頂端膨脹為球囊,球囊隨胃腸蠕動往幽門方向自行進入腸道的過程中,腸內容物隨時被引出,直至抵達梗阻部位,從而達到預期的治療效果。此外,在導管的末端設有一個沖洗接頭和止流夾,若導管前端的側孔吸附腸腔黏膜或被堵塞時,將止流夾扣住減壓管后,經沖洗接頭注入氣體,避免液氣體返流入負壓器,從而避免導管側孔吸附腸粘膜和/或腸內容物引起的管路不通暢。
三、醫療器械臨床試驗前研究
(一)產品性能研究
產品性能評價主要包括外觀、尺寸、物理性能、化學性能、無菌、環氧乙烷殘留等,結果表明產品符合設計輸入要求。參考GB/T 15812- 2005、GB/T 14233. 1-2008、YY 0488-2004等確定了相應的檢驗方法。
(二)生物相容性
產品預期與人體胃腸部位接觸。依據GB/T 16886系列標準提交生物相容性評價資料,包含與人體直接接觸材料的生物學試驗報告,由國家認證認可監督管理委員會認定且在其承檢范圍內的生物學實驗室出具,評價項目為細胞毒性、口腔黏膜刺激、皮膚致敏,符合生物相容性要求。
(三)滅菌
申請人委托第三方進行環氧乙烷滅菌,無菌保證水平(SAL)為10^-6,明確了滅菌參數。依據GB 18279. 1-2015等標準對滅菌參數進行了確認,提交了滅菌確認報告。
(四)產品有效期和包裝
產品的貨架有效期為3年。申請人通過自然老化方式驗證產品的有效期,自然老化試驗37個月,對老化后的包裝進行了封口強度、封口滲漏、阻菌性等測試;同時,對老化后的產品進行了性能驗證,檢驗結果符合要求,支持宣稱的貨架有效期;提交了包裝運輸驗證報告。
四、醫療器械臨床試驗
按照《醫療器械臨床評價技術指導原則》、《醫療器械臨床試驗質量管理規范》要求提交臨床評價資料。
申請人在三家經備案的醫療器械臨床試驗機構開展臨床試驗,提交的臨床評價資料包括倫理批件、臨床試驗協議、臨床試驗方案、臨床試驗分中心小結報告、臨床試驗總報告等。采用多中心單組目標值的臨床試驗,主要終點為置管成功率,對試驗結果進行了統計分析,證明了產品的安全性、有效性。
更多有關醫療器械創新申請及第二類創新醫療器械注冊服務需求,歡迎您隨時方便與杭州證標客醫藥技術咨詢有限公司聯絡,聯系人:葉工,電話:18058734169,微信同。