按照馬來西亞《醫療器械管理法》規定,所有在馬來西亞生產、進口的醫療器械產品都必須在醫療器械管理局進行醫療器械注冊后方可進入市場。對于進口的醫療器械生產商而言,需找到授權代理(authorized represetative,AR)完成注冊事宜。馬來西亞醫療器械監管的主管部門為衛生部下屬的醫療器械管理局(Medical Device Athority,MDA)。
引言:按照馬來西亞《醫療器械管理法》規定,所有在馬來西亞生產、進口的醫療器械產品都必須在醫療器械管理局進行醫療器械注冊后方可進入市場。對于進口的醫療器械生產商而言,需找到授權代理(authorized represetative,AR)完成注冊事宜。馬來西亞醫療器械監管的主管部門為衛生部下屬的醫療器械管理局(Medical Device Athority,MDA)。

馬來西亞醫療器械管理局主要職責范圍是:責成醫療器械廠商(本國或外國)嚴格遵守《醫療器械質量管理體系》(ISO13485)的質量體系要求;指導廠商進行創新產品的臨床試驗;對本國及進口的醫療器械產品進行注冊及疏通醫療器械國內銷售渠道。
一、馬拉西亞醫療器械分類:
在馬來西亞,醫療器械是指制造商為診斷、預防、監測、治療或減輕疾病或傷害而打算單獨或組合用于人類的任何儀器、器械、工具、機器、器具、植入物、體外試劑或校準器、軟件、材料或其他類似或相關物品。
馬拉西亞醫療器械注冊程序和準則嚴格遵循東盟醫療設備指令(AMDD)標準。器械被分為A、B、C、D四類,從低風險分類到高風險分類排序。此外,還有第五類為組合器械。注冊途徑根據設備的分類而有所不同。
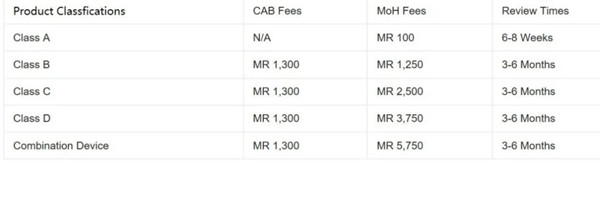
醫療器械注冊申請必須通過在線MEDCAST系統提交,由獲得許可的當地實體公司同時作為License Holder,或Malaysia Authorized Holder(MAH)。許可證可以從一個授權代表(Authorized Representative,簡稱AR)轉移到另一個。新的AR將在衛生部MEDCAST在線門戶網站上填寫一份申請。所需文件包括現任AR申報表(Annex B – MDA/GD0041)、終止信和新AR的授權信。衛生部對每個醫療器械注冊ID收取約500馬幣(115美元)。更多有關馬拉西亞醫療器械注冊服務需求,歡迎您隨時方便與杭州證標客醫藥技術咨詢有限公司聯絡,聯系人:葉工,電話:18058734169,微信同。