一次性使用人體動脈血樣采集器在我國屬于第三類醫療器械注冊產品,2023年6月6日,國家藥監局發布《一次性使用人體動脈血樣采集器注冊審查指導原則(2023年第17號)》,一起來學習新法規,了解一次性使用人體動脈血樣采集器注冊流程和審評要點。
一次性使用人體動脈血樣采集器在我國屬于第三類醫療器械注冊產品,2023年6月6日,國家藥監局發布《一次性使用人體動脈血樣采集器注冊審查指導原則(2023年第17號)》,一起來學習新法規,了解一次性使用人體動脈血樣采集器注冊流程和審評要點。
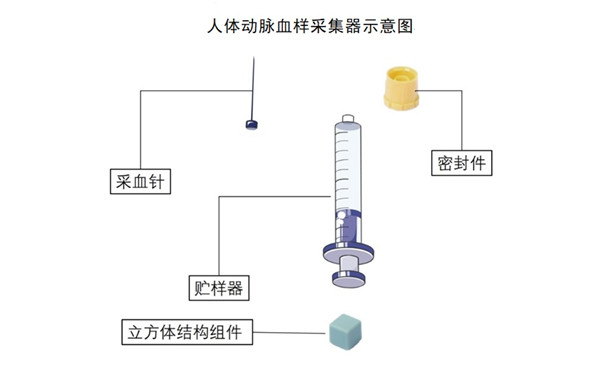
一、一次性使用人體動脈血樣采集器注冊基本知識
一次性使用人體動脈血樣采集器屬于《醫療器械分類目錄》中22臨床檢驗器械目錄下11采樣設備和器具項下01動靜脈采血針及連接件,按照第三類醫療器械管理。產品名稱應符合《醫療器械通用名稱命名規則》《臨床檢驗器械通用名稱命名指導原則》及有關規定。
依據《醫療器械注冊單元劃分指導原則》等文件,主要原材料或添加劑不同、采樣原理不同等,建議區分不同注冊單元,提供各自完整的注冊申報資料。
對于存在多種型號規格的產品,應當明確各型號規格的區別,說明型號規格表述方式中每一字母、數字或符號的代表含義。應當采用對比表及帶有說明性文字的圖片、圖表對各種型號規格的結構組成、功能、產品特征、性能指標等加以描述。
二、一次性使用人體動脈血樣采集器產品技術要求
產品技術要求的制定應符合《醫療器械產品技術要求編寫指導原則》的要求,應根據產品的技術特征和臨床使用情況來確定產品安全有效、質量可控的性能指標與檢驗方法。對宣稱的所有與產品安全有效性相關、可以客觀判斷的技術參數和功能,以及特殊設計、性能和結構,應在產品技術要求中予以規定。產品技術要求中的性能指標應不低于相關的國家標準和行業標準。產品技術要求中的檢驗方法均應為已驗證的方法。對于相關國家標準、行業標準中不適用的推薦要求條款,應說明不適用的原因。
產品技術要求中應明確產品型號規格并闡明各型號規格之間的區別和劃分依據,提供產品結構及示意圖。明確產品各組件的原材料及相應潤滑劑、添加劑,與人體直接或間接接觸的部件,應寫明其原材料牌號或者應符合的國家/行業標準。描述產品滅菌方法、有效期等信息。常見的通用技術指標包括以下項目:
物理和使用性能:
貯樣器:潔凈度、刻度標尺、外套、容量允差、圓錐接頭、器身密合性(抽血型血樣采集器的貯樣器適用)、排氣性和密合性(預設型血樣采集器的貯樣器適用);
采血針:清潔、正直、針座與針管連接牢固度、暢通性、針座與護套配合性、針尖鋒利無缺陷、針管(潤滑劑殘留、清潔無異物、長度)、針座外觀及接頭類型、防針刺保護裝置(激發力、破壞力、抗跌落)(如適用);
其他:密封件密合性;
化學性能:重金屬含量、酸堿度、環氧乙烷殘留量(如適用);
生物性能:無菌、細菌內毒素;
添加劑性能:標識、含量。
三、一次性使用人體動脈血樣采集器性能研究中的關注點予以說明:
1.預設型血樣采集器的采血性能
預設型動脈采血器在臨床使用時將針栓拉到預設位置后實施動脈血樣采集,待動脈血自動充盈采血器至預設位置時結束采集。排氣裝置發揮排出空氣、遇血液封閉作用。應首先明確排氣裝置的材料及工作原理,如尺寸(直徑、厚度)、孔徑、吸液性等。其次結合產品自身特性和臨床使用特點,開展排氣性能和密合性能研究,建議考慮靜壓頭、壓力值、模擬血液等因素的影響。
2.添加劑對樣本分析結果的干擾
應考慮添加劑對樣本分析結果的干擾,目前使用的抗凝劑為肝素。目前已知的肝素對結果的干擾包括稀釋作用、肝素鈉導致鈉離子檢測結果偏高、肝素鋰結合鈣離子導致鈣離子檢測結果偏低、影響酸堿度等情形。對于標稱可用于檢驗血液中相應項目(如酸堿度、鉀、鈉、鈣、氯等電解質、血紅蛋白、紅細胞壓積、葡萄糖和乳酸等)的產品,應提交申報產品不對血液中的這些成分的檢驗帶來影響、或影響可接受的研究資料。
3.采血針結構及性能
采血針是用于刺入動脈并經過它使動脈血樣流入貯樣器的部件。若有,采血針應符合 GB 15811的規定。針尖第一斜面角宜采用短斜面角,若申報產品使用特殊設計的針尖結構,應提供結構示意圖、必要時提供穿刺性能研究資料。為防止采血針的規格色標與添加劑色標相混淆,不推薦采血針規格的色標。明確針管管壁類型,提交針管剛性、韌性、耐腐蝕性等研究資料。
4.密封件結構及性能
密封件用于將采血后的貯樣器密封,使采集的動脈血樣與空氣隔絕。若申報產品帶有密封件,應明確其接頭種類,提供密封性能研究資料。若密封件含有其他特殊設計,應提供相關研究資料,如排氣功能。
5.防針刺裝置
防針刺裝置(若有)不應對器械預期的性能和特征及正常使用后的處理產生負面影響,不應妨礙或者影響對器械預期的臨床使用性能,在預期的使用環境中應該能預防誤激活。建議提供防針刺裝置的激活力(如拉力、壓力、扭力)、破壞力、抗跌落等性能研究資料。一旦器械進入安全模式,意外接觸銳器的風險應被降低到最低限度,提供安全模式下的針尖接觸測試評價資料。應提供防針刺裝置模擬臨床使用測試的研究資料,提供樣本量確定依據、對模擬臨床使用測試結果的分析以及結果和結論的總結。
6.特殊設計、功能和結構
如果產品具有特殊設計、性能和結構,針對特殊之處提供對應研究和驗證資料。若有不符合國家/行業標準的情形,應說明原因,提交特殊設計的科學性和合理性驗證資料。
四、一次性使用人體動脈血樣采集器注冊
按照我國第三類醫療器械注冊流程辦理即可。
更多有關醫療器械注冊服務需求,歡迎您隨時方便與杭州證標客醫藥技術咨詢有限公司聯絡,聯系人:葉工,電話:18058734169,微信同。